Nowe leczenie rzadkiej choroby neuronu ruchowego
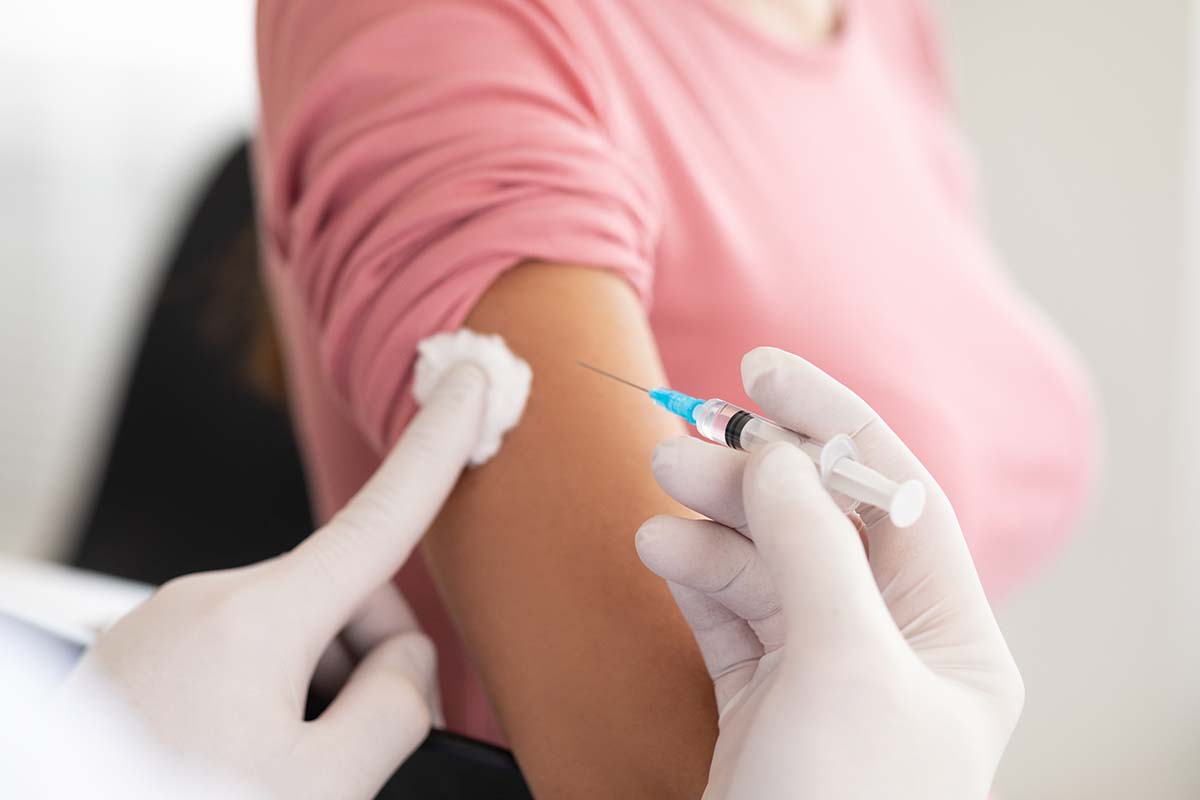
EMA 23 lutego 2024 r. zaleciła wydanie pozwolenia na dopuszczenie do obrotu w krajach UE nowego leku zawierającego tofersen, który będzie miał zastosowanie w leczeniu pacjentów ze stwardnieniem zanikowym bocznym (ALS), którzy osiągnęli 18. rok życia.
Zalecenie to dotyczy pozwolenia na dopuszczenie do obrotu w wyjątkowych okolicznościach – leki dopuszczone na tych zasadach podlegają szczególnemu monitorowaniu po wydaniu zezwolenia. Preparat z tofersenem, o którym mowa, jest wskazany w leczeniu chorych na ALS, u których występuje mutacja w genie dysmutazy ponadtlenkowej-1 (SOD-1).
Przyczyny tej choroby nie są dokładnie znane, ale mówi się, iż należą do nich m.in. czynniki genetyczne oraz środowiskowe. Komórki nerwowe mózgu i rdzenia kręgowego, które mają za zadanie kontrolować ruchy zależne od pacjenta, ulegają wyniszczeniu. Osłabia to funkcjonowanie układu mięśniowego, czego skutkiem w przyszłości może być paraliż mięśni, w tym mięśni oddechowych, co doprowadzić może do niewydolności oddechowej.
Tofersen jest antysensownym oligonukleotydem, który działa poprzez wiązanie się z mRNA genu SOD-1, ograniczając wytwarzanie białka SOD-1. Dzięki zmniejszeniu ilości produkowanego białka SOD-1 tofersen ma łagodzić objawy ALS.
Skuteczność i bezpieczeństwo preparatu z tofersenem zaobserwowano dzięki przeprowadzeniu 28-tygodniowego, randomizowanego, kontrolowanego placebo badania z podwójnie ślepą próbą. Wzięło w nim udział 108 pacjentów w wieku 23–78 lat z ALS i mutacją genu SOD-1. Uczestników przydzielono losowo w stosunku 2:1 – grupa otrzymująca lek dokanałowo vs. grupa placebo. W trakcie badania mierzono łańcuch lekki neurofilamentu osocza (NfL) jako marker uszkodzenia i degradacji aksonów. U pacjentów leczonych preparatem zawierającym tofersen zaobserwowano zmniejszenie stężenia NfL w osoczu o ok. 60% w porównaniu z grupą placebo, co sugeruje zmniejszenie uszkodzenia neuronów.
Najczęściej zgłaszanymi skutkami ubocznymi wynikającymi z zastosowania nowego preparatu były bóle mięśni i stawów, gorączka, zmęczenie oraz podwyższony poziom białych krwinek i białek w płynie mózgowo-rdzeniowym.
Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP), który działa w obrębie Europejskiej Agencji Leków, zwrócił się do wnioskodawcy z prośbą o przedłożenie danych po wydaniu pozwolenia w celu scharakteryzowania długoterminowej skuteczności i bezpieczeństwa produktu zawierającego tofersen na podstawie otwartego, długookresowego badania kontynuacyjnego. Zbadane zostanie m.in. to, czy stosowanie tej substancji może opóźnić pojawienie się objawowej ALS u chorych z przedobjawową SOD-1-ALS bądź temu zapobiec.
Źródło:
https://www.ema.europa.eu/en/news/new-treatment-rare-motor-neurone-disease-recommended-approval, stan z dnia 25.03.2024.