Wróć
Wróć

O wykorzystaniu winianu brymonidyny, nowego surowca farmaceutycznego, w recepturze aptecznej
Brymonidyna, nowy surowiec pro receptura, jest wysoce selektywnym agonistą receptora α2-adrenergicznego. Po aplikacji na skórę substancja zmniejsza rumień (zaczerwienienie), z tego względu znalazła zastosowanie w terapii trądziku różowatego. Preparaty gotowe do stosowania na skórę zawierające w swoim składzie brymonidynę nie są dostępne w Polsce.
Winian brymonidyny (łac. brimonidini tartras) jest wybiórczym agonistą receptora α2-adrenergicznego wykorzystywanym pierwotnie w leczeniu jaskry, nadciśnienia ocznego, a obecnie również trądziku różowatego (łac. rosacea) [1]. Występuje w preparatach gotowych w postaci kropli do oczu oraz żelu do aplikacji na skórę. Winian brymonidyny jest rozpuszczalny w wodzie i przyjmuje postać białego, jasnożółtawego bądź jasnobrunatnawego proszku. Zgodnie z zaleceniami farmakopealnymi stosowany jest zewnętrznie w postaci kropli do oczu w stężeniu 2 mg/mL (2 × dziennie jedna kropla). W Farmakopei brak jest informacji na temat stężeń do podawania na skórę [2]. Żel zawierający 0,33% brymonidyny (co odpowiada 0,5% winianu brymonidyny) został zatwierdzony do leczenia rumieniowej postaci trądziku różowatego w 2013 roku przez Amerykańską Agencję Żywności i Leków (ang. Food and Drug Administration, FDA) oraz w 2014 roku przez Europejską Agencję Leków (ang. European Medicines Agency, EMA) [3]. Należy podkreślić, że lek do stosowania na skórę w postaci gotowej jest niedostępny w Polsce (jedynie w postaci kropli do oczu), zatem wprowadzenie na rynek surowca recepturowego stwarza nowe możliwości w praktyce dermatologicznej.
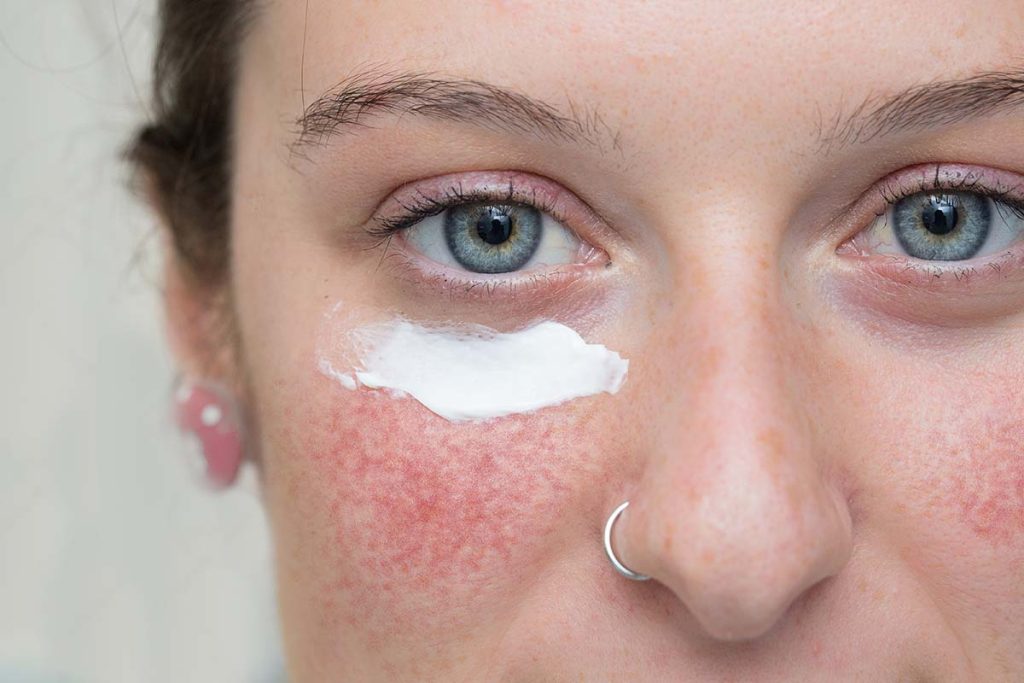
Trądzik różowaty jest przewlekłą chorobą skóry o podłożu zapalnym, która prowadzi do nieprawidłowej reakcji naczyń krwionośnych. Schorzenie dotyczy około 5% populacji i przebiega z okresami zaostrzeń i remisji. Trądzik różowaty charakteryzuje się występowaniem rumienia (przelotnego lub przetrwałego), teleangiektazji (poszerzonych naczyń krwionośnych) i nadwrażliwością skóry na bodźce zewnętrzne. Patomechanizm choroby jest złożony i obejmuje czynniki genetyczne, immunologiczne, infekcyjne i środowiskowe. Chociaż dokładna przyczyna występowania rumienia nie jest znana, istnieje hipoteza, że jest on wynikiem rozregulowania skórnych reakcji naczynioruchowych, co prowadzi do nieprawidłowego rozszerzenia naczyń krwionośnych twarzy pod wpływem różnych bodźców. Badania kliniczne wskazują na udział receptorów adrenergicznych w szlaku regulacji nerwowo-naczyniowej. Wyróżnia się następujące postacie kliniczne trądziku różowatego: teleangiektatyczno-rumieniowatą, która charakteryzuje się występowaniem rumienia i teleangiektazji; grudkowo-krostkową z obecnością przetrwałego rumienia w środkowej części twarzy oraz z okresowo występującymi grudkami i krostami oraz przerostową z występującymi zmianami guzowatymi. Postać oczna obejmuje natomiast przewlekły stan zapalny brzegów powiek, spojówek i rogówek objawiający się łzawieniem i przekrwieniem oczu, pieczeniem, kłuciem, swędzeniem, światłowstrętem i uczuciem obecności ciała obcego w oku. Charakterystyczne są również nawracające gradówki i jęczmienie jako wynik infekcji gronkowcowej [4, 5]. W 2016 roku panel ekspertów z Rosacea Consensus (ROSCO) wprowadził dodatkową klasyfikację trądziku różowatego, która skupia się na objawach występujących u pacjentów. W przedstawionej klasyfikacji wyróżniono objawy pierwszorzędowe zlokalizowane w obrębie środkowej części twarzy: rumień napadowy, rumień utrwalony, grudki, krostki i teleangiektazje oraz objawy drugorzędowe – uczucie pieczenia skóry, suchość skóry, obrzęk, dolegliwości oczne i przerost gruczołów łojowych [6]. Do czynników wyzwalających lub zaostrzających zmiany w przebiegu trądziku różowatego zaliczane są: stres, spożywanie alkoholu, stosowanie leków obniżających stężenie cholesterolu oraz preparatów glikokortykosteroidowych na skórę twarzy czy ekspozycja na słońce. Kontakt z promieniowaniem UV jest bezwzględnie przeciwwskazany w przebiegu trądziku różowatego, może bowiem prowadzić do neowaskularyzacji (powstawania nowych naczyń krwionośnych). U niektórych chorych stwierdza się również współistniejącą kolonizację nużeńcem (łac. Demodex folliculorum) [1, 3, 5].
Leczenie trądziku różowatego obejmuje właściwą pielęgnację skóry, stosowanie ochrony przeciwsłonecznej oraz leczenia miejscowego bądź ogólnego. Aktualne zalecenia wskazują na wybór leków ukierunkowanych na leczenie głównych objawów schorzenia (rumienia, teleangiektazji, uczucia pieczenia) takich jak brymonidyna, oksymetazolina, iwermektyna (o właściwościach przeciwzapalnych oraz aktywności wobec nużeńca), metronidazol, erytromycyna, klindamycyna czy kwas azelainowy [1, 7, 8].
Brymonidyna, występująca w postaci soli – winianu, jest wysoce selektywnym agonistą receptorów α-2-adrenergicznych. Według rekomendacji Polskiego Towarzystwa Dermatologicznego (PTD) żel zawierający 0,5% winianu brymonidyny (co odpowiada 0,33% brymonidyny) wskazany jest do stosowania raz na dobę w rumieniowej postaci trądziku różowatego [5]. Substancja po nałożeniu na skórę wywołuje skurcz mięśni gładkich powierzchownych naczyń krwionośnych (poprzez wiązanie z receptorami α-2), czego efektem jest redukcja zaczerwienienia już po 30 minutach od aplikacji. Efekt utrzymuje się przez około 12 godzin, a szczyt działania obserwowany jest pomiędzy 3. a 6. godziną. Ponadto surowiec wykazuje działanie przeciwzapalne (hamuje również reakcję zapalną wywołaną przez bakterie Cutibacterium acnes, zmniejszając ekspresję cytokin prozapalnych w keratynocytach) oraz zmniejsza obrzęk naczyń krwionośnych. Zalecana maksymalna dawka dobowa to ilość preparatu o łącznej masie 1 g (co odpowiada w przybliżeniu pięciu porcjom wielkości ziarnka grochu) do aplikacji na każdy z pięciu obszarów twarzy: środkową część czoła, podbródek, nos i każdy policzek, równomiernie cienką warstwą, z ominięciem oczu i ust. Podczas pierwszych tygodni terapii skóra może silnie reagować na działanie brymonidyny, z tego względu leczenie należy rozpocząć od nakładania mniejszej (niż dawka maksymalna) ilości preparatu, a następnie zwiększać ją zależnie od odpowiedzi klinicznej i tolerancji pacjenta. Należy mieć na uwadze, że brymonidyna nie powinna być stosowana na podrażnioną skórę ani otwarte rany, a po aplikacji trzeba dokładnie umyć ręce [9–13].
Poza zarejestrowanymi wskazaniami dla winianu brymonidyny istnieją doniesienia naukowe o innych korzystnych efektach jego działania, m.in. w zapobieganiu i zmniejszaniu rumienia oraz reakcji zapalnej występującej po zabiegach z użyciem pulsacyjnego źródła światła (ang. Intense Pulsed Light, IPL) stosowanego m.in. w leczeniu przebarwień i redukcji owłosienia czy jako środka wydłużającego okres działania substancji miejscowo znieczulających. Stosowany jest również jako substancja o działaniu hemostatycznym w drobnych interwencjach chirurgicznych w obrębie skóry i aparatu paznokciowego, w zapobieganiu występowania zespołu zaczerwienienia alkoholowego oraz w zmniejszaniu naczyniaków u niemowląt [10]. Brymonidyna (w stężeniu 0,2%) w połączeniu z tymololem (w stężeniu 0,5%) w postaci kremu okazały się obiecującą alternatywą w miejscowym leczeniu wrzodziejących naczyniaków u dzieci [14]. W małych dawkach (tj. 0,025% winianu brymonidyny) substancja wykorzystywana jest w niwelowaniu zaczerwienienia oczu u osób z prawidłowym ciśnieniem wewnątrzgałkowym (następuje zwężanie naczyń krwionośnych bez zmiany ciśnienia) [10]. Działania niepożądane po miejscowym zastosowaniu brymonidyny występują rzadko i dotyczą tylko skóry w miejscu aplikacji. Do najczęściej występujących objawów zalicza się zaczerwienienie, podrażnienie, świąd, pieczenie, suchość skóry oraz uczucie gorąca. Ponadto może pojawić się paradoksalne nasilenie rumienia oraz kontaktowe zapalenie skóry, jednak zmiany te mają postać łagodną i przemijającą [10]. Brymonidyna bywa również stosowana w połączeniu z metronidazolem, który stanowi lek pierwszego rzutu w postaci grudkowo-krostkowej trądziku różowatego [1, 3].
Metronidazol jest chemioterapeutykiem z grupy pochodnych nitroimidazolu. Wykazuje aktywność pierwotniako- oraz bakteriobójczą wobec drobnoustrojów beztlenowych, działa również przeciwzapalnie i przeciwrumieniowo. Badania in vitro wykazały, że metronidazol zakłóca uwalnianie przez neutrofile reaktywnych form tlenu, które powodują uszkodzenie tkanek w miejscach zapalenia. Aktywność przeciwutleniająca substancji może być podstawą jego działania przeciwzapalnego w terapii trądziku różowatego. Należy mieć na uwadze, że surowiec charakteryzuje się działaniem fotouczulającym, z tego względu zaleca się aplikowanie preparatów z metronidazolem wieczorem i unikanie nasłonecznienia [1, 5]. Zewnętrznie stosowany jest w stężeniu od 0,75% do 2% w postaci maści i kremów [2].
Podłożami przydatnymi w recepturze półstałych preparatów stosowanych w terapii trądziku są Lekobaza PhC, euceryna czy maść cholesterolowa (w przypadku skóry przesuszonej). Lekobaza PhC jest podłożem amfifilowym, ze względu na obecność emulgatorów w/o i o/w do podłoża można jednocześnie wprowadzać roztwory wodne i olejowe. W swoim składzie zawiera ok. 40% wody oczyszczonej. Cechą charakterystyczną podłoża jest praktycznie nieograniczona możliwość wemulgowywania roztworów wodnych aż do uzyskania konsystencji mleczka. Lekobaza PhC jest podłożem zmywalnym wodą, o dobrej rozsmarowywalności i fizjologicznym dla skóry pH (ok. 5,5), nawilża i natłuszcza skórę, nie wykazując właściwości okluzyjnych. Należy mieć na uwadze, że preparaty przygotowywane z wykorzystaniem Lekobazy PhC w mikserze recepturowym najlepiej wykonać na niskich obrotach 2–3. Zbyt wysokie obroty prowadzą bowiem do zwiększenia objętości podłoża w wyniku zatrzymania powietrza w strukturze maści, co może prowadzić do jej wypływania.
Euceryna jest podłożem absorpcyjnym często stosowanym w recepturze aptecznej. Na bazie euceryny sporządzane są maści bezwodne albo kremy w/o. Euceryna trwale wiąże wodę, jej liczba wodna powinna być nie mniejsza niż 300. Należy pamiętać, że w monografii farmakopealnej euceryny umieszczone są dwie maści eucerynowe: maść eucerynowa I (Unguentum Eucerini I, Lanae alcoholum unguentum) oraz maść eucerynowa II (Unguentum eucerini II, Cholesteroli et cetyli unguentum). Euceryna wykazuje silne działanie natłuszczające, nawilżające, zmiękczające oraz kojące. Uwodniona w stosunku 1:1 zapewnia efekt chłodzenia na skórę. Podłoże polecane jest szczególnie do pielęgnacji skóry przesuszonej, podrażnionej i pękającej. Euceryna jest odpowiednia do stosowania na skórę objętą stanem zapalnym, ponieważ nie wykazuje działania drażniącego ani alergizującego.

Maść cholesterolowa to podłoże lipofilowe bezwodne absorpcyjne, emulgujące wodę, w skład którego wchodzi: cholesterol (3 cz.), parafina stała (15 cz.), wazelina biała (18 cz.) i parafina ciekła (64 cz.). Cholesterol występuje w przestrzeniach międzykomórkowych naskórka i z tego względu jest składnikiem dobrze tolerowanym przez pacjentów (nie powoduje nadwrażliwości). Podłoże charakteryzuje się dużym stopniem wchłaniania wody, tworząc emulsje w/o (LW 120–200). Wykazuje działanie nawilżające, natłuszczające, kojące, zmiękczające, łagodzące (nie powoduje uczuleń) [2, 15, 16].
W przypadku postaci leku aplikowanych na skórę najczęściej stosuje się winian brymonidyny w stężeniu 0,5% (co odpowiada 0,33% w przeliczeniu na brymonidynę), jednak w praktyce dermatologicznej stosowane są zarówno niższe (0,25–0,5%), jak i wyższe (do 1%) stężenia [3, 16]. Sporządzanie leków recepturowych stwarza możliwość dopasowania stężenia substancji czynnej do indywidualnych potrzeb pacjenta, wskazań terapeutycznych i stopniowego oswojenia skóry z jej działaniem.
W Tabeli 1 przedstawiono przykładowe składy półstałych leków recepturowych z winianem brymonidyny.
Źródła:
Gawęda, A. i in. Rosacea – a modern view of diagnostics and treatment. J. Edu. Health Sport. 2023, 46, 258–272.
Farmakopea Polska XIII Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Polskie Towarzystwo Farmaceutyczne, Warszawa 2023.
Del Rosso, J. i in. Update on the management of rosacea from the American Acne & Rosacea Society (AARS). JCAD, 2020, 13, S17.
Woźniacka, A. i in. Rosacea. Diagnostic and therapeutic recommendations of the Polish Dermatological Society. Part 1. Epidemiology, classification and clinical presentation. Przegl. Dermatol. 2022, 109–121.
Woźniacka, A. i in. Rosacea – diagnostic and therapeutic recommendations of the Polish Dermatological Society. Part 2. Treatment. Przegl. Dermatol. 2022, 109, 397–416.
Schaller, M. i in. Rosacea treatment update: recommendations from the global ROSacea COnsensus (ROSCO) panel. Br. J. Dermatol. 2017, 176, 283–284.
Zhang, H. i in. Rosacea treatment: review and update. Dermatol. Therap. 2021, 11, 13–24.
Patel, N. i in. Oxymetazoline hydrochloride cream for facial erythema associated with rosacea. Expert Rev. Clin. Pharmacol. 2017, 10, 1049–1054.
Mirvaso ChPL: https://ec.europa.eu/health/documents/community-register/2018/20181122142608/anx_142608_pl.pdf, stan z dn. 12.09.2024.
Saki, N. i in. Efficacy and safety of topical brimonidine in dermatology: a review article. Dermatol. Ther. 2022, 35, e15819.
Johnson, A.W.; Johnson, S.M. The role of topical brimonidine tartrate gel as a novel therapeutic option for persistent facial erythema associated with rosacea. Dermatol. Ther. 2015, 5, 171–181.
Choi, S-R. i in. Novel anti-inflammatory effects of brimonidine on Propionibacterium acnes-induced inflammatory reaction. Ann. Dermatol. 2020, 32, 342–344.
Muhammad, H.H.A. i in. Role of topical brimonidine in the treatment of dermatological diseases. EJHM, 2023, 90, 875–878.
Almebayadh, M. Successful treatment of ulcerated infantile hemangioma with brimonidine-timolol cream: 2 cases report and review of the literature. J. Dermatolog. Treat. 2020, 31, 433–434.
Jachowicz R. (red.). Receptura apteczna. Podręcznik dla studentów farmacji. Wydawnictwo Lekarskie PZWL, Warszawa 2015.
Strona internetowa: akademiafagronu.pl, stan z dnia 18.09.2024.