Wróć
Wróć

O wykorzystaniu ditranolu w terapii łuszczycy cz. 2
Tlenek cynku obecny w podłożu ze względu na swój zasadowy charakter prowadzi do utleniania ditranolu do brunatnych pochodnych, co zaobserwować można już po kilku godzinach od wykonania preparatu, a w konsekwencji – do zaniku działania farmakologicznego leku. Aby zapobiec utlenieniu surowca, do preparatu należy wprowadzić kwas salicylowy (przed dodaniem cygnoliny) w celu zneutralizowania składnika alkalicznego (tlenku cynku). Kwas salicylowy dezaktywuje tlenek cynku, tworząc salicylan cynku, a także zapewnia kwaśne środowisko, co prowadzi do spowolnienia procesu utleniania ditranolu. Dodatek kwasu salicylowego w stężeniu 2% jest wystarczający, aby zachować cygnolinę w aktywnej leczniczo, zredukowanej formie podczas stosowania preparatu. Poniżej przedstawiono przykład recepty zawierającej w swoim składzie cygnolinę i tlenek cynku oraz kwas salicylowy [4–6, 8].
Rp. 11
Cignolini 0,05
Hydrocortisoni 0,125
Anaesthesini 1,5
Ac. salicylici 5,0
Zinci oxidi 25,0
Vaselini flavi ad 75,0
M.f. ung.
Mechanizm działania anestezyny polega na blokowaniu kanałów sodowych w komórce nerwowej, co skutkuje brakiem stymulacji receptora bólowego i wywołaniem efektu znieczulającego. Stosowana w celu zniesienia bólu i neutralizacji świądu. Jest najmniej toksyczna spośród substancji znieczulających stosowanych w recepturze aptecznej. Tlenek cynku wykazuje działanie ściągające i przeciwbakteryjne.
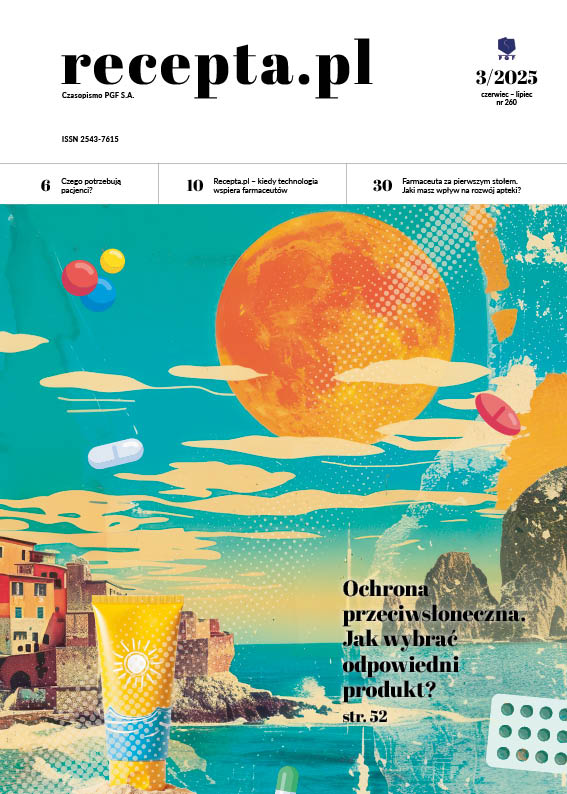
Do rozkładu ditranolu może dojść również w przypadku zastosowania jako vehiculum lanoliny, smalcu czy lekobazy. W Zakładzie Farmacji Stosowanej Uniwersytetu Medycznego w Białymstoku przeprowadzono doświadczenie mające na celu określenie stabilności ditranolu w zależności od zastosowanego podłoża oraz temperatury przechowywania preparatu. Smalec to podłoże lipofilowe stanowiące mieszaninę triglicerydów nasyconych i nienasyconych kwasów tłuszczowych. Charakteryzuje się ograniczoną trwałością (szybko ulega procesowi jełczenia), która związana jest z obecnością łatwo utleniających się nienasyconych kwasów tłuszczowych, co może prowadzić do degradacji ditranolu. Zaobserwowano, że w celu zapewnienia stabilności takiego preparatu, musi on być przechowywany w lodówce, nie ma natomiast konieczności wprowadzania kwasu salicylowego do preparatu (Rp. 12, Rycina 3).
Rp. 12
Cignolini 0,3
Adipis suilli ad 100,0
M.f. ung.
Lanolina jest podłożem lipofilowym absorbcyjnym. Z uwagi na zróżnicowany skład (stanowi mieszaninę estrów kwasów tłuszczowych i alkoholi sterolowych z wolnymi alkoholami sterolowymi i alifatycznymi) oraz obecność nadtlenków może przyspieszać rozkład cygnoliny [5]. W przypadku maści sporządzonej na bazie lanoliny zastosowanie 2-procentowego kwasu salicylowego i przechowywanie preparatu w lodówce pozwoli zahamować rozkład ditranolu (Rycina 4). Jednak ze względu na swoją lepkość, specyficzny zapach oraz potencjał alergizujący, lanolina rzadko bywa przepisywana jako samodzielne podłoże.

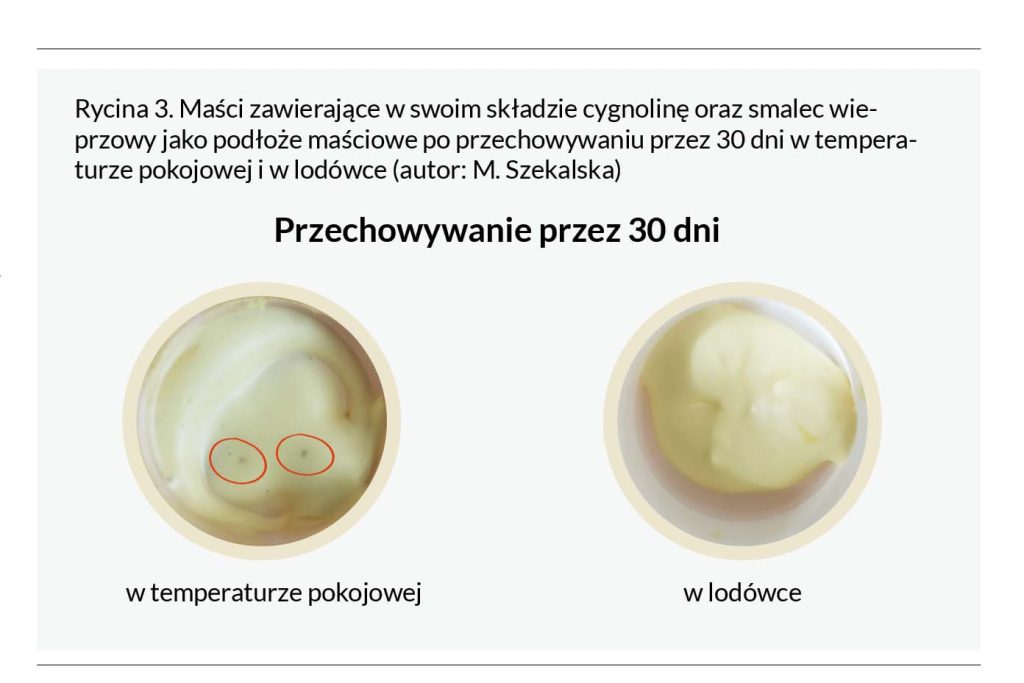
Lekobaza to amfifilowe, wieloskładnikowe podłoże charakteryzujące się łatwą zmywalnością, dobrą rozsmarowywalnością i fizjologicznym dla skóry pH (ok. 5,5). W skład lekobazy wchodzą: wazelina biała, emulgatory w/o i o/w, woda oczyszczona oraz różne substancje pomocnicze (w zależności od producenta) [5, 6]. Z uwagi na znaczny stopień uwodnienia podłoża (35–42%) w przypadku zastosowania Lekobazy PhC jako podstawy maściowej dla cygnoliny, jedynie preparaty z dodatkiem kwasu salicylowego w stężeniu 2% i przechowywane w lodówce wykazywały stabilność (Rycina 5).
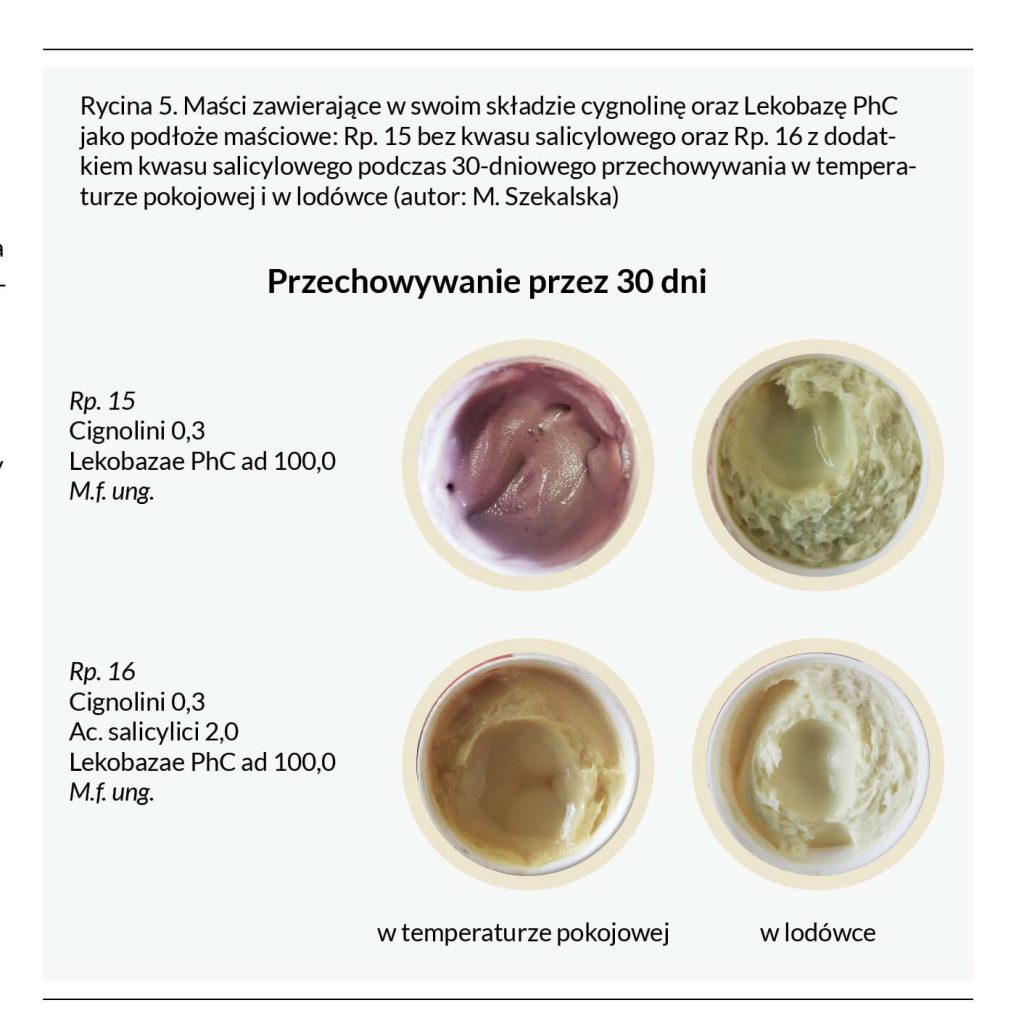
Co ciekawe, w przeprowadzonych badaniach wykazano, że Lekobaza Lux (podłoże lipofilowe uwodnione, krem o miękkiej konsystencji o charakterze emulsji w/o) pomimo znacznej zawartości wody (ok. 65%) zapewnia stabilność cygnoliny podczas 30-dniowego przechowywania w temperaturze pokojowej. W przypadku zastosowania tego podłoża nie był konieczny dodatek kwasu salicylowego (Rycina 6). Prawdopodobnie związane jest to z niższym pH podłoża (ok. 3,5–5,0), dodatkiem witaminy E, która wykazuje działanie przeciwutleniające, oraz obecnością środka konserwującego – sorbinianu potasu.
Przykładem preparatu spotykanego w praktyce aptecznej, którego wykonanie sprawia trudność farmaceutom, jest recepta nr 18. Mydło potasowe (łac. Sapo kalinus) to surowiec o mazistej konsystencji wykazujący działanie keratoplastyczne oraz keratolitycznie, dzięki czemu ułatwia wnikanie substancji leczniczych. Ponadto, wykorzystywane jest jako środek przeciwłojotokowy, myjący, wysuszający, odtłuszczający i oczyszczający. Mydło potasowe znalazło również zastosowanie jako łagodny środek antyseptyczny. Surowiec otrzymywany jest w procesie zmydlania oleju lnianego za pomocą wodnego roztworu wodorotlenku potasu w podwyższonej temperaturze. Charakteryzuje się zasadowym pH w zakresie 9–10 [11].
Rp. 18
Cignolini 0,5
Ac. salicylici 5,0
Ol. Ricini
Sapo viridis aa 15,0
Ol. Rapae ad 100,0
M.f. susp.
W recepcie 18. występuje szereg niezgodności recepturowych, których przyczyny wynikają zarówno z niewłaściwego zapisu recepty, jak również z nieodpowiedniego sposobu łączenia składników i sporządzania leku. Ze względu na zasadowy charakter mydła potasowego może dojść do degradacji cygnoliny, natomiast pod wpływem kwasu salicylowego dochodzi do hydrolizy mydła potasowego. Niepożądana jest również obecność oleju rzepakowego – zarówno mydło potasowe, jak i kwas salicylowy nie ulegną rozpuszczeniu, z kolei przepisana ilość oleju rycynowego jest zbyt mała, aby rozpuścić w nim kwas salicylowy (rozpuszczalność 1:10). Wykonanie zawiesiny o powyższym składzie nie jest zatem możliwe. Po zamianie oleju rzepakowego na olej rycynowy oraz wyłączeniu mydła potasowego z uwagi na jego sedymentację nie jest z kolei możliwe uzyskanie stabilnej zawiesiny po 30 s wytrząsania (zgodnie z zaleceniami farmakopealnymi), co niesie za sobą ryzyko wystąpienia działań niepożądanych. Stężenie cygnoliny nie będzie jednakowe w całej objętości leku, istnieje zatem niebezpieczeństwo podrażnienia, a nawet oparzenia skóry. Najlepszym rozwiązaniem wydaje się wyłączenie mydła potasowego i oleju rzepakowego ze składu recepty, wprowadzenie zgodnego podłoża maściowego (np. wazeliny białej, hydrofilowej czy maści cholesterolowej) w ilości potrzebnej do sporządzenia preparatu (ad 100,0) i sporządzenie maści. Istnieje jednak możliwość wykonania leku bez konieczności eliminacji mydła potasowego – należy zastosować odpowiednią kolejność łączenia składników, a podczas wykonywania preparatu unikać bezpośredniego kontaktu mydła potasowego z cygnoliną i kwasem salicylowym. W pierwszym etapie przygotowywania leku należy rozetrzeć lege artis kwas salicylowy z niewielką ilością podłoża (stworzyć koncentrat maści), dodać cygnolinę – rozcierać, następnie wprowadzać porcjami pozostałą część podłoża oraz mydło potasowe. Podczas łączenia mydła potasowego z podłożem należy zastosować intensywne mieszanie, aby uniknąć jego miejscowej koncentracji wpływającej na degradację ditranolu. Do tak przygotowanej maści należy dodać olej rycynowy w przepisanej przez lekarza ilości, stosując krótki okres mieszania (30 s). Maść należy bezwzględnie przechowywać w lodówce (Rycina 7), a także zaleca się zastosowanie wazeliny hydrofilowej, euceryny bądź maści cholesterolowej jako podłoża do jej sporządzenia. W przypadku wykorzystania wazeliny białej czy żółtej maść odznacza się niejednorodną konsystencją, a Lekobaza Lux nie łączy się z mydłem potasowym oraz z olejem rycynowym [4–6, 11].
Na występujące podczas terapii cygnolinowej przebarwienia skóry można zastosować preparaty recepturowe (recepty nr 20 i 21) umożliwiające wyrównanie jej kolorytu, zawierające w swoim składzie substancje o działaniu złuszczającym i wybielającym.

Rp. 21
Ac. salicylici 10,0
Sulfuris praecipitati 12,0
Sapo viridis 10,0
Vaselini flavi ad 100,0
M.f. ung.
Rp. 22
Bismuthi subnitratis 5,0–20,0
Ac. salicylici 1,0
Eucerini ad 100,0
M.f. ung.
Źródła:
- Farmakopea Polska XIII. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Polskie Towarzystwo Farmaceutyczne, Warszawa, 2023.
- Sehgal, V.N.; Verma, P.; Khurana, A. Anthralin/dithranol in dermatology: anthralin/dithranol. Int. J. Dermatol. 2014, 53, e449–e460.
- Pavithran, K. Dithranol: recent views on its mechanism of action. Indian J. Dermatol. Venereol. Leprol. 2001, 67, 104–105.
- Kuriata, E. Ordynacje leków recepturowych z dithranolem. Extemporaneous prescriptions with dithranol. Farmacja współczesna, 2014, 7, 1–7.
- Marszałł, L. Receptura apteczna półstałych postaci leków do stosowania na skórę w teorii i praktyce. Farmapress, Warszawa, 2015.
- Jachowicz, R. (red.). Receptura apteczna. Podręcznik dla studentów farmacji. Wydawnictwo Lekarskie PZWL, Warszawa 2021.
- Sznitowska, M. (red.). Farmacja stosowana. Technologia postaci leku. Wyd. Wydawnictwo Lekarskie PZWL, Warszawa 2017.
- Gajewska M., Sznitowska M. (red.). Podstawy receptury aptecznej. Materiały do ćwiczeń dla studentów farmacji. Wyd. Fundacja Pro Pharmacia Futura, Warszawa 2019.
- Janicki, S.; Szulc, J.; Woyczikowski, B., Receptariusz, Wyd. Medyk, Warszawa 1992.
- Chmielak, W. Ściąga z receptury. Edycja IV. ITEM Publishing, Szczecin 2014.
- Szekalska, M.; Winnicka, K. Wykorzystanie Sapo kalinus w recepturze aptecznej, Recepta.pl, 2018, 6-7, 34–37.