Wróć
Wróć

Zastosowanie leku recepturowego w terapii atopowego zapalenia skóry, część 2.
Preparaty o działaniu przeciwzapalnym i przeciwświądowym.
Charakterystycznym objawem atopowego zapalenia skóry (AZS) jest przewlekły, nawrotowy stan zapalny skóry z towarzyszącym intensywnym świądem. Stosowane miejscowo glikokortykosteroidy stanowią podstawę terapii AZS, a leczenie ustala się indywidualnie, biorąc pod uwagę rodzaj i nasilenie zmian skórnych oraz wiek pacjenta.
Atopowe zapalenie skóry (AZS) jest przewlekłą dermatozą zapalną o złożonej etiopatogenezie, której cechą charakterystyczną jest wielopostaciowość zmian skórnych. Mając na uwadze, że u chorych stwierdza się zaburzenia immunologiczne, dysfunkcję bariery naskórkowej oraz procesów obronnych skóry, celem leczenia jest przede wszystkim zahamowanie stanu zapalnego.
Mimo że podawanie ogólnie działających glikokortykosteroidów jest niezwykle skuteczną opcją terapeutyczną w leczeniu AZS, powinno się ich unikać ze względu na wywoływanie wielu ogólnoustrojowych działań niepożądanych i stosować znacznie bezpieczniejszą terapię miejscową. Miejscowo stosowane glikokortykosteroidy (mGKS) uznawane są za leki pierwszego wyboru w terapii AZS. Leczenie miejscowe ustala się indywidualnie, biorąc pod uwagę rodzaj i nasilenie zmian skórnych oraz wiek pacjenta [1–5]. Wytyczne opublikowane przez Europejską Akademię Dermatologii i Wenerologii (European Academy of Dermatology and Venereology) podkreślają szczególne znaczenie mGKS ze względu na ich działanie antyproliferacyjne, przeciwzapalne, przeciwświądowe, immunosupresyjne, a także zdolność hamowania kolonizacji skóry gronkowcem złocistym (Staphylococcus aureus) – patogenem, do zakażeń którym często dochodzi w przebiegu AZS [6]. Aktywność terapeutyczna mGKS zależy od ich budowy chemicznej, rodzaju podłoża, w którym są podawane, sposobu aplikacji, powierzchni i okolicy ciała, na którą się je stosuje, oraz charakteru zmian skórnych [2, 4].
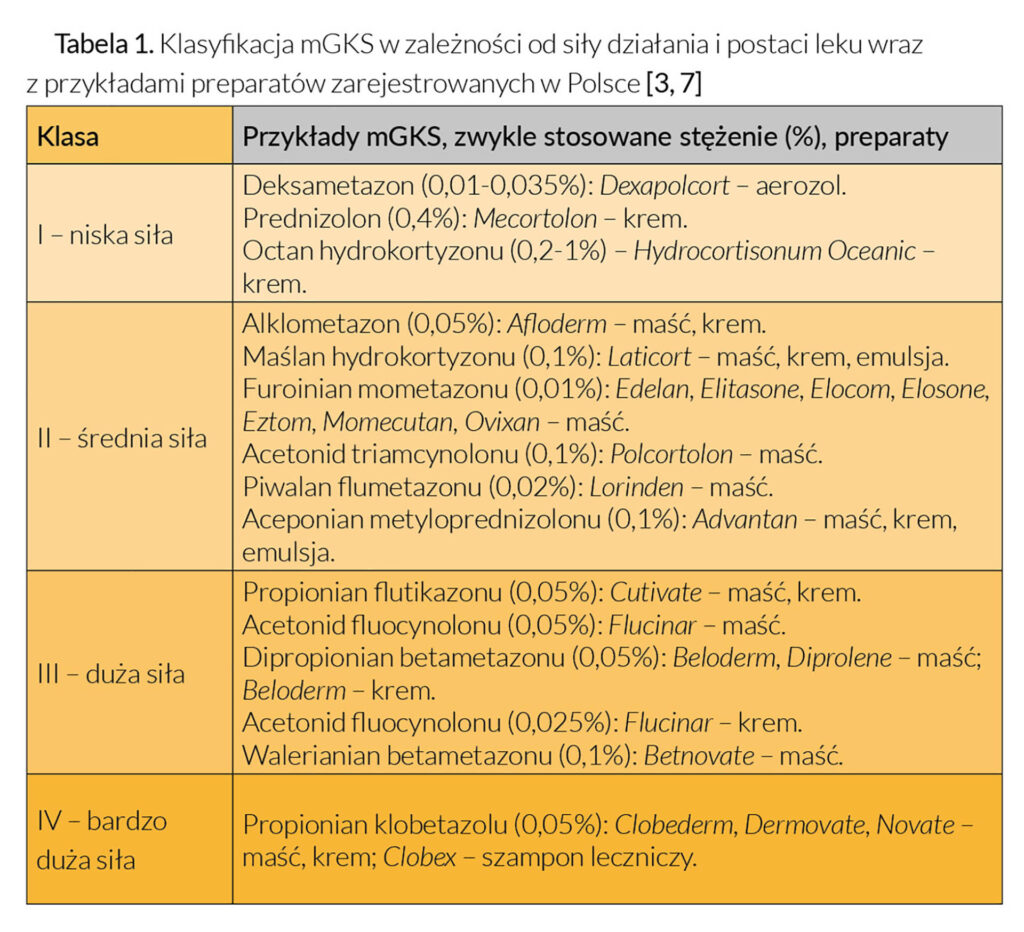
Miejscowo działające glikokortykosteroidy podzielono na cztery grupy (klasyfikacja europejska), w zależności od ich siły działania. Grupa I odpowiada substancjom o najsłabszej aktywności, natomiast grupa IV substancjom najsilniejszym (Tabela 1). Podziału tego dokonano na podstawie testu wazokonstrykcji naczyń (VCA, ang. vasoconstrictor assay), czyli tzw. testu zblednięcia, który polega na ocenie zblednięcia skóry po miejscowej aplikacji preparatu glikokortykosteroidowego pod opatrunkiem okluzyjnym [3, 4].
W celu zminimalizowania wchłaniania ogólnoustrojowego pacjent nie powinien stosować więcej niż 40–50 g silnego mGKS i nie więcej niż 90–100 g mGKS o umiarkowanej sile działania tygodniowo.
Miejscowe glikokortykosteroidy o niskiej sile działania aplikowane są zazwyczaj na twarz i szyję, błony śluzowe oraz okolice pachwin u dzieci, a także u pacjentów dorosłych z łagodnym przebiegiem choroby. W przypadku mniej delikatnych obszarów ciała początkowa terapia obejmuje zwykle preparaty o średniej sile, a następnie mGKS wykazujące silniejszą aktywność, szczególnie w przypadku przewlekłych zmian niewrażliwych na działanie substancji o sile niższej. Natomiast mGKS o dużej i bardzo dużej sile działania są zwykle zarezerwowane do krótkotrwałego leczenia obszarów objętych liszajami u dorosłych. Po ustąpieniu zmian ponownie stosuje się preparaty słabsze jako terapię podtrzymującą.
Ze względu na swoją lipofilowość mGKS łatwo przenikają przez skórę i błony śluzowe. Transdermalne wchłanianie mGKS zależy od ich budowy chemicznej, zastosowanych substancji pomocniczych, stopnia uszkodzenia bariery naskórkowej, miejsca aplikacji oraz wieku pacjenta, a także podłoża, w jakim znajduje się substancja lecznicza. Jednocześnie należy podkreślić, że stosowane podłoża wpływają dodatkowo na poprawę tolerancji miejscowych preparatów steroidowych oraz wzbogacają je o właściwości pielęgnacyjne – natłuszczają i nawilżają powierzchnię skóry. mGKS w postaci maści stosowane są na zmiany suche, łuszczące się i spękane, natomiast podłoża hydrofilowe, które są podstawą kremów, w mniejszym stopniu penetrują skórę i mogą być stosowane na wszystkie obszary ciała, a także na aktywne zapalnie zmiany sączące [1, 3, 4, 8].
Szczególną ostrożność należy zachować, stosując preparaty z mGKS w populacji pediatrycznej. W związku z odmiennością budowy skóry u dzieci substancje te powinny być aplikowane bardzo rozważnie, pod ścisłą kontrolą dermatologiczną. Z powodu niepełnego rozwoju funkcji bariery ochronnej i znacznego stopnia uwodnienia skóry przenikanie leków jest zwiększone. Istotny jest także stosunek powierzchni skóry do wagi ciała, który u pacjentów pediatrycznych jest znacznie większy niż u dorosłych, co może sprzyjać występowaniu ogólnoustrojowych objawów niepożądanych. Powinno się również pamiętać, że stosowanie pieluch i przyleganie fałdów skórnych (zarówno u dzieci, jak i u dorosłych) może wywierać działanie podobne do opatrunków okluzyjnych. U niemowląt nie należy aplikować mGKS w okolicach odbytu i narządów płciowych. Wyjątkową ostrożność (nawet u starszych dzieci) należy zachować także przy stosowaniu mGKS na skórę twarzy (szczególnie okolice oczu) ze względu na niebezpieczeństwo rozwoju jaskry [3, 5, 6, 8].
W terapii AZS stosowane są różne schematy aplikowania mGKS. Pierwszym z nich jest sposób ciągły, który polega na codziennym stosowaniu mGKS, zaczynając od substancji silnie działającej, przechodząc do preparatu o mniejszej aktywności. Według aktualnie obowiązujących zaleceń stosowanie mGKS w modelu terapii ciągłej ograniczone jest do kilku dni [6]. Inny schemat leczenia stanowi terapia naprzemienna, która opiera się na aplikowaniu mGKS oraz emolientu na zmianę, np. w dni parzyste mGKS, w dni nieparzyste emolient; stnieje tu także tzw. terapia trzydniowa (przez 3 kolejne dni mGKS, przez następne 3 dni emolient), terapia weekendowa (mGKS 2 razy w tygodniu, w pozostałe dni emolient) oraz terapia pulsowa (aplikowanie mGKS 3 razy co 12 godz., następnie w pozostałe dni emolient). Stosowanie emolientów w skojarzeniu z mGKS jest obligatoryjne w terapii AZS, ponieważ preparaty te stanowią barierę okluzyjną dla skóry, zatrzymują wilgoć i chronią ją przed podrażnieniami [2–6].
W recepturze aptecznej spośród miejscowo stosowanych w terapii AZS glikokortykosteroidów dostępny jest hydrokortyzon oraz prednizolon.
Należy mieć na uwadze, że w wyniku długotrwałego stosowania mGKS może dojść do rozwoju tachyfilaksji (zjawisko występowania szybkiej utraty wrażliwości na lek w przypadku jego częstego podawania, bez odpowiednich przerw), co prowadzi do zmniejszenia skuteczności substancji przy dalszym stosowaniu bądź do zaostrzenia stanu zapalnego po przerwaniu terapii. Zjawisko może zostać zminimalizowane poprzez zmianę leczenia na mGKS o mniejszej sile działania, a także rzadsze stosowanie leku. Również zastosowanie terapii alternatywnej, np. inhibitorami kalcyneuryny, przywraca wrażliwość na glikokortykosteroidy, natomiast zastosowanie terapii łączonej (np. inhibitory kalcyneuryny w dni powszednie, a preparaty glikokortykosteroidowe w weekendy) zmniejsza występowanie objawów ubocznych. Jeżeli leczenie wymaga podawania leków dłużej niż 2 tygodnie do ustąpienia stanu zapalnego, zalecane jest stosowanie wyłącznie inhibitorów kalcyneuryny – maści i kremów z takrolimusem w stężeniu 0,1% w przypadku występowania zmian umiarkowanych lub pimekrolimusem w stężeniu 1% w stanach łagodnych. Substancje te – zgodnie z charakterystyką produktów leczniczych – zarejestrowane są do stosowania u dzieci od 2 r.ż., jednak doświadczenie lekarzy klinicystów wskazuje, że są bezpieczne nawet u niemowląt w terapii off label [3, 9]. Należy mieć na uwadze, że miejscowe stosowanie GKS może powodować rozwój istotnych działań niepożądanych, takich jak atrofia skóry, uszkodzenie naczyń krwionośnych, trądzik steroidowy, nadwrażliwość kontaktowa czy działanie ogólnoustrojowe. Bezpieczna steroidoterapia miejscowa opiera się na prawidłowo dobranej sile działania, dawce oraz sposobie aplikacji leku [2, 4, 6].
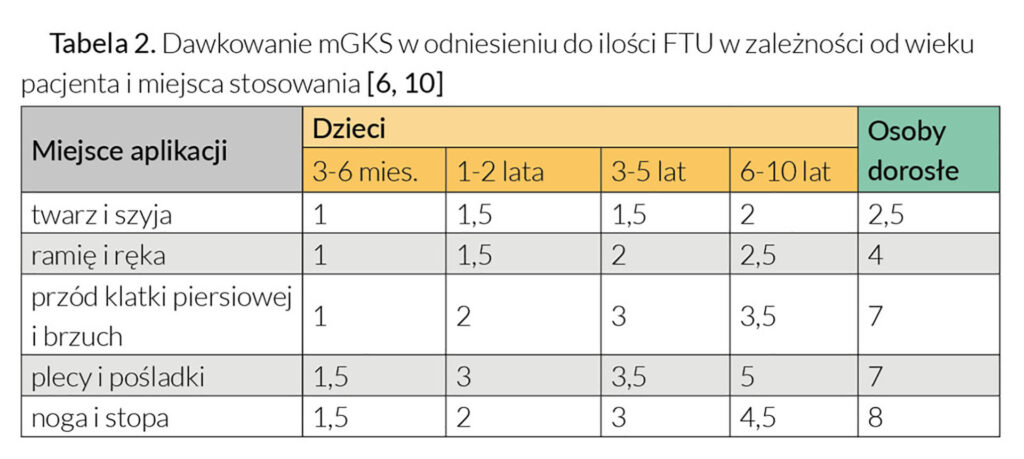
Ważną kwestią w przypadku stosowanych miejscowo glikokortykosteroidów jest również właściwy dobór dawki preparatu oraz sposób jego aplikacji. W celu zminimalizowania wchłaniania ogólnoustrojowego pacjent nie powinien stosować więcej niż 40–50 g silnego mGKS i nie więcej niż 90–100 g mGKS o umiarkowanej sile działania tygodniowo. Lekarze często zalecają, aby aplikować je „oszczędnie” lub „w cienkiej warstwie”, jednak sformułowania te są nieprecyzyjne i mogą być niewłaściwie interpretowane. Z punktu widzenia pacjenta, w przeciwieństwie do stałych postaci leku, dawkowanie maści czy kremów jest nieoczywiste. Szczególną trudność sprawia określenie, ile preparatu miejscowego powinien użyć pacjent do leczenia konkretnej okolicy ciała. Z tego względu, w celu ujednolicenia dawkowania mGKS, rekomenduje się stosowanie „jednostki opuszki palca” (FTU, fingertip unit). FTU odpowiada około 500 mg (0,5 g) formulacji i jest to ilość preparatu w postaci maści czy kremu wyciśnięta przez końcówkę tuby o średnicy 5 mm nakładana od czubka palca wskazującego do pierwszego zgięcia stawowego osoby dorosłej [3–6, 10]. Liczba jednostek FTU potrzebnych do leczenia poszczególnych okolic ciała w zależności od wieku pacjenta przedstawiona jest w Tabeli 2.
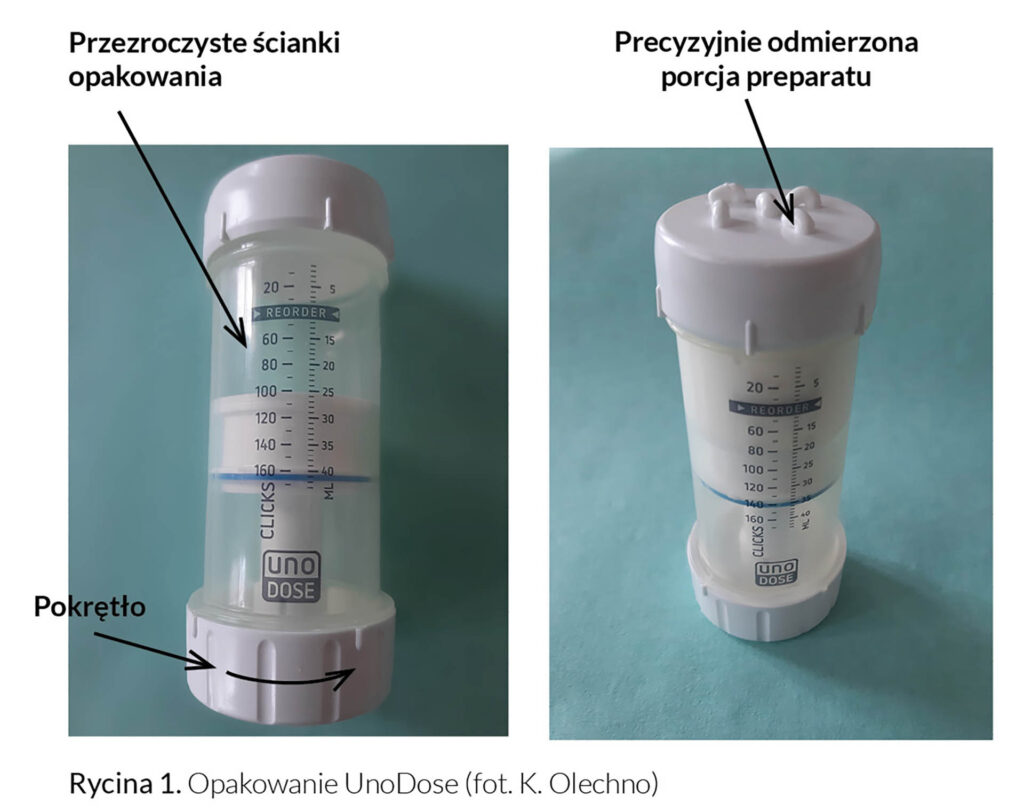
W przypadku silnie działających leków, które wymagają precyzyjnego dawkowania (np. mGKS), istotną rolę odgrywa także opakowanie bezpośrednie, w którym znajduje się preparat. Nowoczesnym, od niedawna dostępnym w Polsce opakowaniem dla półstałych postaci leku jest pojemnik z dozownikiem UnoDose (Rycina 1). Pojemnik ten zapewnia dokładność dozowania preparatu (0,25 ml dla pojedynczego „obrotu”) oraz możliwość wizualnej kontroli ilości pozostającej w opakowaniu dzięki przezroczystym ściankom. Jest to szczególnie ważne w codziennym użytkowaniu i przekłada się na poprawę bezpieczeństwa oraz compliance pacjentów. Opakowanie to umożliwia rozsmarowanie preparatu na powierzchni skóry bezpośrednio z pojemnika, bez potrzeby aplikacji leku ręką, co zabezpiecza zawartość przed zanieczyszczeniami zewnętrznymi, zmniejsza straty leku, a także zapobiega wchłanianiu substancji czynnych przez zdrową skórę dłoni. Podczas pobierania postaci leku słyszalne jest charakterystyczne, wyraźne „kliknięcie” dozownika, świadczące o odmierzeniu odpowiedniej ilości preparatu. Opakowanie umożliwia przygotowanie leku przy użyciu miksera recepturowego bezpośrednio w tubie [11]

Dokładnym i uniwersalnym narzędziem umożliwiającym precyzyjne dawkowanie półstałej postaci leku recepturowego jest ponadto końcówka dozująca GAKO (adapter ExactDose™), dzięki której jednorazowo odmierzana jest porcja 0,5 ml preparatu przy każdym obrocie „motylka” (Rycina 2), co jest szczególnie przydatne w przypadku formulacji zawierających w swoim składzie substancje silnie działające. Końcówkę dozującą GAKO nakręca się na końcówkę tuby od miksera aptecznego. Należy podkreślić, że pasuje ona do wszystkich rodzajów pojemników (tub) stosowanych podczas przygotowania preparatu w mikserze recepturowym. Stosowanie nowoczesnych opakowań jest wyjątkowo ważne w codziennym użytkowaniu i przekłada się na poprawę bezpieczeństwa oraz compliance pacjentów [12].
Zaletą leku sporządzanego w aptece jest możliwość indywidualizacji terapii poprzez dobór stężenia substancji aktywnych czy sporządzania unikalnych kompozycji i postaci leków dla konkretnego pacjenta. Lek recepturowy jest lekiem bezpiecznym – nie wymaga stosowania dodatkowych substancji pomocniczych o potencjalnych właściwościach podrażniających, takich jak środki konserwujące, barwniki czy środki zapachowe, które zawarte są w preparatach produkowanych przemysłowo. Wystąpienie reakcji nadwrażliwości na składniki preparatu minimalizowane jest prostym składem leku recepturowego. W recepturze aptecznej spośród miejscowo stosowanych w terapii AZS glikokortykosteroidów dostępny jest hydrokortyzon oraz prednizolon. Z uwagi na to, że skóra osób cierpiących na AZS jest sucha i podatna na swędzenie, stosowane są także substancje wykazujące działanie przeciwświądowe, tj. prometazyna czy benzokaina. Receptura apteczna stwarza również możliwość aplikacji składników aktywnych w odpowiednim podłożu, które jest produktem leczniczym per se [13, 14].
Recepta 1
Rp.
Hydrocortisoni 1,0
Glyeroli 10,0
Lekobazae LUX ad 100,0
M.f. cremor
Podczas wykonywania leku recepturowego zawierającego hydrokortyzon należy pamiętać, że substancja wykazuje tendencję do zbijania się w aglomeraty, co stwarza ryzyko otrzymania preparatu o nierównomiernym rozproszeniu i zmiennym stężeniu. W celu uniknięcia tego zjawiska zalecane jest dokładne roztarcie substancji z niewielką ilością podłoża w pierwszym etapie przygotowania preparatu, a następnie dodanie pozostałej jego części. Preparat jest dobrze tolerowany w terapii zmian zlichenifikowanych. Lekobaza Lux charakteryzuje się dobrymi właściwościami nawilżającymi ze względu na znaczną zawartość wody (65%) i obecność glicerolu. W skład podłoża wchodzi także palmitynian izopropylu, który posiada właściwości nawilżające i pobudzające wzrost zdrowych komórek naskórka. Podłoże dobrze natłuszcza powierzchnię skóry, co zapewnia ochronę przed wysychaniem.
Recepta 2
Rp.
Hydrocortisoni 1,5
Ureae 5,0
Aquae 25,0
Vaselini hydrophylici ad 100,0
M.f. ung.
Mocznik w stężeniach od 2,0 do 5,0% działa nawilżająco. Wazelina hydrofilowa charakteryzuje się dużą zdolnością wiązania wody (liczba wodna co najmniej 250). Dzięki zawartości wosku białego, który utwardza konsystencję podłoża, może być stosowana w ciepłej porze roku. Wemulgowywanie roztworu wodnego mocznika spowoduje zmianę konsystencji wazeliny hydrofilowej na bardziej miękką i łatwiej rozsmarowywalną.
Recepta 3
Rp.
Hydrocortisoni 0,5
Acidi salicylici 1,0
Ureae 5,0
Eucerini
Aquae
Vaselini albi aa ad 50,0
M.f. ung.4
W moździerzu należy dokładnie rozetrzeć kwas salicylowy z 1 g euceryny, aby uzyskać odpowiednie rozdrobnienie substancji. W celu ułatwienia wykonania preparatu można wykorzystać dostępny na rynku zmikronizowany kwas salicylowy. Następnie należy wprowadzić hydrokortyzon i dokładnie rozetrzeć, dodawać porcjami pozostałą ilość podłoża. Po wymieszaniu wprowadzić porcjami roztwór mocznika. Kwas salicylowy stosowany zewnętrznie w stężeniu 1–3% wykazuje działanie dezynfekujące, a w stężeniu do 2% keratoplastyczne (normalizuje rogowacenie naskórka).
Recepta 4
Rp.
Hydrocortisoni 0,5
Promethazini h/ch 2,0
Paraffini liq. 6,0
Vaselini hydrophylici ad 100,0
M.f. ung.
Parafina wzbogaca maść o właściwości zmiękczające i natłuszczające. Tworzy na powierzchni skóry powłokę ochronną, dzięki czemu zmniejsza parowanie wody, zwiększając jej zawartość w naskórku.
Recepta 5
Rp.
Prednisoloni 0,25
Ureae 5,0
Aquae 15,0
Ung. cholesteroli ad 100,0
M.f. ung.
W tubie miksera aptecznego należy umieścić maść cholesterolową oraz prednizolon w celu zawieszenia surowca w podłożu. Mocznik należy rozpuścić w wodzie, porcjami wprowadzić do podłoża. Maść cholesterolowa charakteryzuje się bardzo dużym stopniem wchłaniania wody, tworząc emulsje w/o. Wykazuje działanie nawilżające, natłuszczające, kojące, zmiękczające, zabezpiecza skórę przed utratą wody.
Recepta 6
Rp.
Prednisoloni 0,5
Benzocaini 5,0
Pentravani ad 100,0
M.f. cremor
Pentravan jest podłożem o konsystencji lekkiego kremu, typu emulsja olej w wodzie (o/w). W jego składzie obecne są liposomy, które mają wpływ na poprawę penetracji substancji czynnych. Wykonując preparat na bazie Pentravanu, należy pamiętać, że silne mieszanie podłoża uszkadza struktury liposomalne, z tego względu używając miksera aptecznego, wskazane jest stosowanie jak najniższych obrotów (1–2).
Recepta 7
Rp.
Prednisoloni 0,03
Vit. A sol. oleosae 3,0
Eucerini
Aquae aa ad 100,0
M.f. ung.
W tubie miksera aptecznego należy umieścić eucerynę oraz prednizolon w celu zawieszenia substancji w podłożu, następnie do pojemnika porcjami wprowadzać wodę. Ostatnim etapem jest dodanie witaminy A i ponowne mieszanie. Witamina A bierze udział w procesach keratynizacji i zmniejsza rogowacenie naskórka, zapewnia odpowiednie nawilżenie.
Słowniczek
Hydrokortyzon (Hydrocortisonum, Locoid, Hydrocortison, Kortyzol, Hydrokortyzon; wykaz B, FP XII) jest najczęściej wykorzystywanym mGKS w recepturze aptecznej. Zewnętrznie stosowany jest w postaci kremu, maści czy zawiesiny w stężeniu 0,25–2,5% [13]. FP XII wyróżnia hydrokortyzon oraz octan i wodorobursztynian hydrokortyzonu, natomiast jako surowiec pro receptura dostępny jest jedynie niezwiązany estrowo hydrokortyzon. Mechanizm działania substancji polega na hamowaniu syntezy leukotrienów, prostaglandyn i cytokin oraz wydzielania histaminy. Hydrokortyzon należy do leków steroidowych o aktywności przeciwzapalnej, przeciwświądowej i przeciwobrzękowej. Poprzez hamowanie działania hialuronidazy zmniejsza przepuszczalność naczyń włosowatych. Substancja ta często wybierana jest jako miejscowy środek przeciwzapalny szczególnie przez pediatrów ze względu na swoje relatywnie łagodne działanie i możliwość zastosowania stężenia dopasowanego do wieku dziecka. Należy mieć jednak na uwadze, że hydrokortyzon, mimo że należy do grupy mGKS o niskiej sile działania, niewłaściwie stosowany może wywoływać efekty niepożądane, do których zalicza się m.in.: ścieńczenie naskórka i skóry właściwej w miejscu aplikacji, zanik tkanki podskórnej, rozstępy, trądzik posteroidowy, przebarwienia, zwiększoną skłonność do nadkażeń bakteryjnych, wirusowych oraz grzybiczych [3].
Prednizolon (Prednisolonum, Encortolon, Dehydrohydrocortisonum; wykaz B, FP XII) wykazuje działanie przeciwzapalne i przeciwświądowe. Hamuje uwalnianie mediatorów reakcji zapalnej (prostaglandyn i leukotrienów) oraz rozszerzanie naczyń włosowatych, zatrzymując napływ leukocytów do miejsca stanu zapalnego i zmniejszając obrzęk. Siła jego działania przeciwzapalnego jest 4–5 razy większa w porównaniu z hydrokortyzonem. Stosowany jest zewnętrznie w stężeniu 0,25–0,5% [3, 13].
Chlorowodorek prometazyny (Promethazini hydrochloridum, Promethazinum hydrochloricum, Diphergan; wykaz B, FP XII) hamuje powstawanie reakcji alergicznych i zapalnych objawiających się obrzękiem, świądem, pokrzywką i bólem. Stosowany jest zewnętrznie w stężeniu do 3% [3, 13].
Benzokaina (Aethylum aminobenzoicum, Ethylis aminobenzoas, Anaesthesinum, Anaesthin; wykaz B, FP XII) w terapii AZS używana jest w celu złagodzenia świądu. Mechanizm jej działania polega na blokowaniu kanałów sodowych w komórce nerwowej, co skutkuje brakiem stymulacji receptora bólowego oraz wywołaniem efektu znieczulającego i jednocześnie przeciwświądowego. Według FP XII może być stosowana jedynie zewnętrznie w postaci roztworu w stężeniu od 1 do 3%, zawiesiny w stężeniu do 5% oraz maści w stężeniu do 10% [3, 13]. Jest najmniej toksyczna spośród substancji znieczulających stosowanych w recepturze aptecznej – aplikowana zewnętrznie słabo wchłania się do krwiobiegu, z tego względu charakteryzuje się dobrym profilem bezpieczeństwa po podaniu na zmienioną chorobowo skórę w przebiegu AZS [3, 13, 15–17].
W przebiegu AZS skóra pacjentów podatna jest na nadkażenia bakteryjne i grzybicze. Z tego względu do terapii włączane są miejscowo działające antybiotyki bądź substancje przeciwgrzybicze, którym poświęcona zostanie kolejna część artykułu.
Stosowanie emolientów w skojarzeniu z mGKS jest obligatoryjne w terapii AZS, ponieważ preparaty te stanowią barierę okluzyjną dla skóry, zatrzymują wilgoć i chronią ją przed podrażnieniami.
Źródła:
- Thomsen, S.F. Atopic dermatitis: natural history, diagnosis, and treatment. International Scholarly Research Notices Allergy, 2014, Article ID 354250, 7 pages.
- Humbert, P.; Guichard, A. The topical corticosteroid classification called into question: towards a new approach. Exp. Dermatol. 2015, 24, 393–395.
- Braun-Falco, O.; Burgdorf, W.H.C.; Plewig, G. al. Dermatologia. Czelej, wyd. 3, t. V, Lublin 2017.
- Jeziorkowska, R.; Jędrzejowska-Sysa, A.; Samochocki, Z. Topical steroid therapy in atopic dermatitis in theory and practice. Postępy Dermatol Alergol. 2015, 32, 162–166.
- Lyons, J.J.; Milner, J.D.; Stone, K.D. Atopic dermatitis in children: clinical features, pathophysiology and treatment. Immunol. Allergy Clin. North Am. 2015, 35, 161–183.
- Wollenber, A.; Barbarot, S.; Bieber, T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J. Eur. Acad. Dermatol. Venereol. 2018, 32, 657–682.
- Rejestr produktów leczniczych. Dostępne online: pub.rejestrymedyczne.csioz.gov.pl (stan z dnia 8.02.2021).
- Paterson, D.A.; Hallier, J.; Jenkins, E. et al. Is the skin absorption of hydrocortisone modified by the variability in dosing topical products? Pharmaceutics. 2018, 10, 9.
- Luger, T.; Boguniewicz, M.; Carr, W. Pimecrolimus in atopic dermatitis: consensus on safety and the need to allow use in infants. Pediatr. Allergy Immunol. 2015, 26, 306–315.
- Long, C.C.; Finlay, A.Y. The fingertip unit: a new practical measure. Clin. Exper. Dermatol. 1991; 16: 444–446.
- Opakowanie UnoDose. Dostępne online: https://eprus.pl/pojemnik-tuba-na-masc-z-dozownikiem-0-25ml-syste,3,931,2975 (stan z dnia 8.02.2021).
- Końcówka dozująca GAKO. Dostępne online: https://shop.fagron.pl/pl-pl/product/401179/końc-c3-b3wka--dozuj-c4-85-ca-gako.aspx (stan z dnia 8.02.2021).
- Farmakopea Polska XII. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Polskie Towarzystwo Farmaceutyczne, Warszawa 2020.
- Wykaz surowców farmaceutycznych dopuszczonych do obrotu w Polsce. Dostępne online: https://sf.rejestrymedyczne.csioz.gov.pl/?AspxAutoDetectCookieSupport=1#results (stan z dnia 8.02.20201).
- Gajewska, M.; Sznitowska, M. (red.). Podstawy receptury aptecznej. Materiały do ćwiczeń dla studentów farmacji. Fundacja Pro Pharmacia Futura, Warszawa 2019.
- Jachowicz R. (red.). Receptura apteczna. Podręcznik dla studentów farmacji. Wydawnictwo Lekarskie PZWL, Warszawa 2015.
- Krówczyński, L.; Jachowicz, R. Ćwiczenia z receptury. Wydawnictwo Uniwersytetu Jagiellońskiego,
Kraków 2000. - Poradnik receptury współczesnej Fagron cz. 1, wydanie II poprawione 2015 Fagron sp. z o.o. Kraków 2015.
- Strona internetowa: fagron.pl (stan z dnia 8.02.2021).
- Aplikacja mobilna: Fagron Receptura (stan z dnia 8.02.2021).
- Oleogel. Dostępne online: https://actifarm.pl/produkty-podloza-oleogel/ (stan z dnia 8.02.2021).
- Katalog produktów Fagron. Dostępne online: https://pl.fagron.com/sites/default/files/page/attachment/fapl_katalog_2018_q34e.pdf (stan z dnia 8.02.2021).