Wróć
Wróć

Nowelizacja ustawy refundacyjnej oraz ustaw pokrewnych – kalendarium dla aptekarzy
1.11.2023
✔ Nowe zasady realizacji recept rocznych
21.09.2023 – wydanie leku na nie więcej niż 120 dni stosowania
1.11.2023 – możliwość wydania kolejnej ilości po upływie ¾ okresu poprzedniej realizacji recepty
1.03.2024 – obliczanie ilości leku przez system P1
Zgodnie z Komunikatem MZ z dnia 22.09.2023 r. w przypadku realizacji recepty elektronicznej, od dnia 21 września 2023 r., pacjent może otrzymać maksymalnie ilość produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego niezbędną do 120-dniowego okresu stosowania, niezależnie od tego, kiedy recepta została wystawiona i na jaki okres. Dotyczy to zarówno recept realizowanych po raz pierwszy, jak i recept, których realizację rozpoczęto przed 21 września 2023 r., przy czym nie ma znaczenia czy pacjent tę receptę będzie realizował jednorazowo czy częściami.
W praktyce oznacza to, że jeśli pacjent rozpocznie realizację recepty rocznej i wykupi lek do 120-dniowej terapii, kolejną ilość leku na 120 dni terapii będzie mógł wykupić dopiero po 90 dniach od poprzedniej realizacji recepty. Wydanie maksymalnej ilości na 120 dni kuracji może być realizowane w ramach częściowej realizacji recepty.
Obliczenie ilości leku do wydania pacjentowi ma przejąć system P1. Nie dotyczy to ilości leku recepturowego oraz ilości leku przeznaczonego do stosowania na okres nie dłuższy niż 120 dni.
Zmieniane przepisy: art. 96a ust. 7a pkt 2 oraz art. 96a ust. 7aa i ust. 7ab Prawa farmaceutycznego.
✔ Wprowadzenie obowiązku wystawiania recept Rpw i na leki psychotropowe wyłącznie w postaci elektronicznej
Wprowadzono zmianę, która zastrzega wystawianie recept wyłącznie w postaci elektronicznej dla leków wydawanych z przepisu lekarza, zawierających środki odurzające lub substancje psychotropowe, określone w odrębnych przepisach – Rpw oraz innej kategorii dostępności, zawierające w swoim składzie substancję psychotropową lub środek odurzający, należące do grupy II-N, III-P albo IV-P określonej w ustawie o przeciwdziałaniu narkomanii.
Recepty wystawione do 31 października 2023 r. włącznie zachowują swoją ważność.
Z tego obowiązku wyłączono lekarzy weterynarii, którzy nadal będą mogli wystawiać recepty na te leki w postaci papierowej.
Zmieniane przepisy: art. 95b ust 1a Prawa farmaceutycznego.
✔ Wprowadzenie nowego rozumienia adnotacji „nie zmieniać” na recepcie
Wprowadzono zmianę, która uniemożliwia zastrzeganie na recepcie konieczności wydania pacjentowi wyłącznie określonego produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego – na rzecz wprowadzenia możliwości zamieszczania na recepcie „informacji o zasadności” wydania pacjentowi określonego produktu i pod warunkiem uzasadnionych wskazań medycznych lub udokumentowanych działań niepożądanych występujących przy zastosowaniu tego produktu leczniczego.
W praktyce oznacza, to że zapis „nie zamieniać” (NZ) nie będzie już miał charakteru zastrzeżenia i nie będzie tym samym bezwzględnie wiążący dla aptekarza.
Ze zmianą wiąże się obowiązek nałożony na osobę wystawiającą receptę do zamieszczania w dokumentacji medycznej pacjenta szczegółowego uzasadnienia przepisania temu pacjentowi określonego leku.
Wydanie zamiennika będzie możliwe na żądanie lub za zgodą pacjenta, jeżeli całkowita ilość substancji czynnej albo substancji czynnych, zawartych w wydawanym leku, odpowiada całkowitej ilości substancji czynnej albo substancji czynnych zawartych w przepisanym na recepcie leku, a produkty te posiadają również te same wskazania i tę samą drogę podania.
Zmieniane przepisy: art. 96 a ust. 1d, ust. 1da oraz ust. 1 db Prawa farmaceutycznego.
✔ Zmiany preferencyjne dla przedsiębiorców, którzy zdecydują się na produkcję leków w Polsce oraz obniżenie odpłatności pacjenta za lek produkowany w Polsce
Wprowadzono możliwość wykorzystania dodatkowych preferencji dla przedsiębiorców, którzy zdecydują się na produkcję w Polsce leków oferowanych na polskim rynku. Przy przyznaniu preferencji administracyjnych i ekonomicznych w toku składania wniosków o objęcie refundacją będą brane pod uwagę dwa kryteria: czy lek jest wytwarzany w Polsce oraz czy lek jest wytwarzany z substancji czynnej wytworzonej w Polsce.
Wprowadzono również obniżenie odpłatności pacjenta za lek znajdujący się na liście refundacyjnej. Odpowiednio obniżka będzie wynosiła:
- 10 % dla leku wytwarzanego w Polsce bądź wytwarzanego z substancji czynnej wytworzonej w Polsce;
- 15 % dla leku wytwarzanego w Polsce, z substancji czynnej również wytworzonej w Polsce.
Koszt obniżki ma być finansowany przez Fundusz.
Zmieniane przepisy: art. 6 ust. 2a oraz art. 13 ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
✔ Wprowadzenie maksymalnej wartości marży na leki recepturowe
Uregulowano marżę na leki recepturowe (w wysokości 25%, liczonej od kosztu jego sporządzenia, wynoszącej nie więcej niż koszt wykonania leku recepturowego przygotowywanego w warunkach aseptycznych). W praktyce oznacza to, że całkowita wartość marży nie będzie mogła być wyższa niż 24,66 zł.
Zmieniane przepisy: art. 7 ust. 8 ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
✔ Zmiana marży hurtowej oraz urzędowej tabeli marż detalicznych na leki refundowane
- 11.2023 – wersja przejściowa do 31.12.2024
- 1.01.2025 – wersja ostateczna
Podwyższono urzędową marżę hurtową, którą z poziomu wysokości 5% ustalono na poziomie 6% ceny zbytu netto leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, nie niższej niż 0,50 zł i nie wyższej niż 150 zł w przypadku leku, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego dostępnego w aptece na receptę. Natomiast górne ograniczenie marży w przypadku leków stosowanych w chemioterapii i w programie lekowym wyniesie 2 000 zł. Podwyższono również marżę detaliczną na leki refundowane. Podwyższenie zostało zaplanowane na dwa etapy:

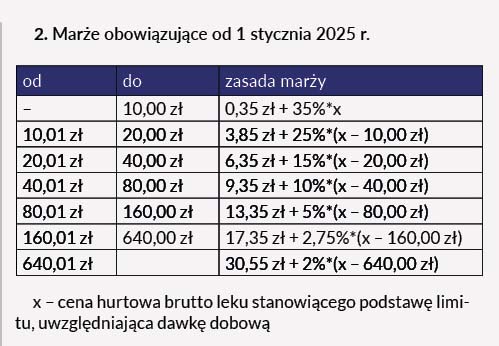
Zmieniane przepisy: art. 7 oraz art. 15 ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
✔ Zmiany w zakresie cofnięcia zezwolenia na prowadzenie apteki
Wprowadzono możliwość odstąpienia od cofnięcia zezwolenia na prowadzenie apteki ogólnodostępnej, w przypadku gdy stwierdzone naruszenie dot. istnienia tzw. odwróconego łańcucha jest znikome.
Wprowadzono również możliwość cofnięcia zezwolenia w przypadku zbycia produktów leczniczych, środków spożywczych specjalnego przeznaczenia żywieniowego lub wyrobów medycznych niezgodnie z zasadami reglamentacji.
Zmieniane przepisy: art. 103 Prawa farmaceutycznego.
1.01.2024
✔ Zmniejszenie częstotliwości publikowanych obwieszczeń refundacyjnych oraz wprowadzenie możliwości zwrotu leku usuniętego z listy refundacyjnej
Obwieszczenia Ministra Zdrowia w sprawie wykazu refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego i wyrobów medycznych będą publikowane raz na 3 miesiące, czyli rzadziej, niż było to dotychczas (raz na 2 miesiące), najpóźniej 14 dni przed zmianą.
Wprowadzono również możliwość zwrotu leku, którego usunięto z listy refundacyjnej (w sytuacji, gdy skrócono decyzję o objęciu refundacją, lub dla którego decyzja ta wygasła). Apteka będzie mogła zwrócić taki lek w terminie 30 dni od dnia wejścia w życie obwieszczenia refundacyjnego. Dla hurtowni przewidziano termin 45 dni na zwrot leku do podmiotu odpowiedzialnego.
Zmieniane przepisy: art. 34a oraz art. 37 ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
✔ Dostarczanie leków zagrożonych brakiem dostępności do co najmniej 10 hurtowni w równej części
Wprowadzono rozwiązanie, że w przypadku zagrożenia brakiem dostępności na terytorium Polski leków, środków spożywczych specjalnego przeznaczenia żywieniowego lub wyrobów medycznych objętych refundacją w kategorii dostępności refundacyjnej na receptę, producent obowiązany będzie do dostarczenia produktów zagrożonych dostępnością w równej części do co najmniej 10 przedsiębiorców prowadzących hurtownie farmaceutyczne, w ilości koniecznej do zabezpieczenia pacjentów. Wykaz takich hurtowni będzie ustalany raz w roku do 30 kwietnia.
To rozwiązanie będzie dotyczyć tylko refundowanych produktów zagrożonych dostępnością, ogłoszonych przez MZ w Dzienniku Urzędowym.
W praktyce oznacza to, że otrzymanie leków deficytowych objętych tym mechanizmem będzie możliwe tylko z określonych hurtowni.
Zmieniane przepisy: art. 34 ust. 3a–3d ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
✔ Zmiany w lekach recepturowych
- 1 .01.2024 – obowiązywanie limitów (ogłoszenie wykazu przez MZ ma nastąpić jeszcze w roku 2023); kolejna zmiana będzie obowiązywać od 1.07.2024
Wprowadzono limit finansowania jednostkę surowca farmaceutycznego do sporządzania leków recepturowych (15 percentyla rozkładu cen danego surowca farmaceutycznego w roku poprzedzającym). Wykazy limitów będą ustalane przez Prezesa NFZ raz do roku i nie będą mogły przekroczyć 30 percentyla rozkładu cen z roku poprzedniego. Wykazy limitów będą obowiązywać od 1 lipca danego roku. W sytuacji, gdy apteka kupi surowiec, który będzie droższy niż wskazany limit finansowania, wówczas to pacjent pokryje różnicę pomiędzy ceną nabycia surowca a limitem finansowania. W sytuacji gdy lek jest wieloskładnikowy, pacjent będzie musiał zapłacić różnicę za przekroczenie limitu każdego surowca wchodzącego w skład leku.
Zmieniane przepisy: art. 6 ust. 8a–8e ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
✔ Uregulowanie zasad prowadzenia przez apteki ogólnodostępne dyżurów w porze nocnej oraz w dni wolne od pracy
Doprecyzowano pojęcie dyżuru w aptece. Jest to praca apteki w dzień wolny od pracy, tj. w niedziele i święta przez 4 godziny zegarowe w godzinach między 10.00 a 18.00 oraz w porze nocnej przez 2 godziny zegarowe w godzinach między 19.00 a 23.00.
Podmiot prowadzący aptekę będzie miał obowiązek przekazania zarządowi powiatu (albo prezydentowi miasta w przypadku miasta na prawach powiatu), na terenie którego znajduje się apteka, rozkładu godzin pracy tej apteki na dany rok najpóźniej do dnia 30 września roku poprzedzającego rok, w którym ma być podjęta uchwała zarządu powiatu. Będzie również obowiązek informowania zarządu powiatu o zmianach tego rozkładu z co najmniej 30-dniowym wyprzedzeniem. Przywołane obowiązki dotyczą rozkładu pracy nie tylko w porze nocnej oraz w dni wolne od pracy, lecz także w dni powszednie.
W 2024 r. podmiot prowadzący aptekę ogólnodostępną będzie musiał przekazać zarządowi powiatu albo prezydentowi miasta na prawach powiatu, w którym znajduje się ta apteka, rozkład godzin pracy tej apteki na dany rok w terminie do dnia 31 stycznia 2024 r.
Obowiązek wyznaczenia dyżurów będzie dotyczył tylko tych powiatów, których siedziba nie przekracza 40 tys. mieszkańców. W pozostałych przypadkach taki obowiązek będzie dotyczył tylko tych powiatów, w których zarząd powiatu uzna pełnienie takich dyżurów za konieczne dla zaspokojenia potrzeb ludności.
Pełnienie przez aptekę dyżurów na podstawie uchwały zarządu powiatu będzie podlegać finansowaniu NFZ. Wyjątkiem będzie pełnienie dyżurów w tzw. rozszerzonym zakresie godzinowym, tj. w czasie powyżej kolejnych 4 godzin zegarowych w przedziale czasowym między godzinami 10.00 a 18.00 (dla pracy w dni wolne) lub powyżej kolejnych 2 godzin zegarowych w przedziale czasowym między godzinami 19.00 a 23.00 (dla pracy w porze nocnej). Wówczas to powiat będzie musiał sfinansować pełnienie dyżurów w zakresie wykraczającym ponad wskazany zakres godzinowy.
Wynagrodzenie ryczałtowe ma stanowić równowartość 3,5% minimalnego wynagrodzenia za pracę określonego na podstawie przepisów o minimalnym wynagrodzeniu za pracę, w przeliczeniu na 1 godzinę faktycznie przeprowadzonego dyżuru.
Zmieniane przepisy: art. 94 Prawa farmaceutycznego.