Postępy farmakoterapii padaczki
Rodzaje padaczek: uogólnione i ogniskowe
W przypadku padaczek uogólnionych zapis EEG przedstawia wyładowania bioelektryczne neuronów występujące jednocześnie i synchronicznie w obydwu półkulach mózgowych. Zawsze towarzyszy im utrata świadomości, ale nie obserwuje się objawów zwiastujących napad, czyli tzw. aury.
Wśród napadów padaczkowych wyróżniamy:
a) Napady nieświadomości:
- typowe – charakterystyczna jest nagła utrata świadomości z „wpatrzeniem się” w jeden punkt, znieruchomieniem, „zawieszeniem” i bez objawów ruchowych; jednak mogą się pojawić nieznaczne, kilkukrotne mrugnięcia powiekami i zmiany w napięciu mięśni; po napadzie osoba kontynuuje „przerwane” działanie;
- atypowe – do napadu nieświadomości dołączają się drgania w obrębie ust, mruganie powiekami, wzmożenie lub obniżenie napięcia mięśni; trwają dłużej od napadów typowych.
Napady nieświadomości mogą pojawiać się kilkakrotnie w ciągu dnia i trwać około 15 sekund (napady typowe) lub dłużej (napady atypowe). Najczęściej są wyzwalane przez hiperwentylację, czyli zwiększoną wentylację płuc obejmującą nieprawidłowe przyspieszenie i/lub pogłębienie się oddechu. Pozostałe czynniki sprzyjające atakom to brak snu, zmęczenie, stres lub spożycie alkoholu.
b) Napady miokloniczne – skurcze ruchowe mięśni szyi, tułowia i kończyn, widoczne jako drgawki całego ciała, które trwają krótko i nawracają.
c) Napady toniczne – charakteryzujące się wzrostem napięcia mięśniowego i nagłym, silnym skurczem symetrycznych grup mięśniowych. Dochodzi do nich zazwyczaj przed zaśnięciem lub po obudzeniu.
d) Napady toniczno-kloniczne – obserwuje się utratę świadomości i przebieganie w dwóch fazach:
w fazie tonicznej początkowo następuje skurcz mięśni całego ciała z wydaniem charakterystycznego, nieświadomego okrzyku, związanego z wypychaniem powietrza z klatki piersiowej przez napięte struny głosowe; oddech ulega zatrzymaniu lub staje się nieregularny, co razem z silnym skurczem ciała sprzyja niedotlenieniu, objawiającemu się zasinieniem ust i skóry; może pojawić się szczękościsk, ślinotok i związane z tym przygryzienie języka lub śluzówki policzka; faza kloniczna to wystąpienie skurczów mięśni i drgawek całego ciała; po tym chory zapada w sen ponapadowy trwający od kilku minut do kilku godzin (u dzieci); wówczas oddech jest ciężki, głośny i chrapliwy, a osoba po napadzie zazwyczaj nie pamięta, co się działo.
e) Napady atoniczne – typowy jest dla nich spadek napięcia mięśniowego; trwają bardzo krótko, a ich częstym symptomem są upadki, po których chory na ogół wstaje sam, ale z urazem głowy, otarciami czy zwichnięciami. Napad może przebiegać jako chwilowa niezdolność do podjęcia aktywności ruchowej (napad akinetyczny) i/lub z jednostronnym napadem drgawek. U dzieci napady akinetyczne mogą współwystępować z miokloniami, po których następuje osłabienie napięcia mięśniowego, upadek lub opadnięcie głowy.
Padaczki ogniskowe to takie, w których występują napady częściowe. W napadach częściowych wyładowania bioelektryczne zachodzą w ogniskach padaczkowych zlokalizowanych w jednej półkuli lub jednej części półkuli. Podczas napadu mogą pojawić się zaburzenia świadomości oraz bardziej uogólnione skurcze mięśniowe.
Obraz napadu zależy od tego, w jakiej części mózgu doszło do wyładowania:
- napady czołowe manifestują się drgawkami klonicznymi, „marszem jacksonowskim” (rozprzestrzenianie się napadu od ręki/stopy w kierunku korpusu, czyli dosiebnym) oraz drgawkami asymetrycznymi, które otoczenie odbiera jako dziwaczne hiperkinezy (ruchy mimowolne);
- napady z płata ciemieniowego obejmują spaczenie czucia, czyli parestezje, objawiające się dolegliwościami, których się nie doświadcza w normalnych warunkach, a zalicza się do nich mrowienia, drętwienia, nieprawidłowe odczuwanie ciepła i zimna;
- napady z płata skroniowego to najczęstsze napady, w których możliwe jest wystąpienie aury obejmującej wrażenia smakowe (posmak metaliczny), węchowe (napady hakowe – odczuwanie niemiłych i dziwacznych zapachów), słuchowe (szumy), wzrokowe (zmiana kształtu); pojawiają się także automatyzmy, np. bezcelowe chodzenie, stereotypowe ruchy rąk (skubanie ubrania, zacieranie rąk, niekontrolowane ruchy wargami); w płacie skroniowym mają też swój początek napady z objawami psychicznymi, takimi jak zjawisko déjà vu (poczucie już widzianego), jamais vu (poczucie nigdy niewidzianego), natrętne i przykre wspomnienia, napady myślowe, zaburzenia afektu (od manii po depresję), objawy wytwórcze (urojenia i omamy), „wrażenie zniekształcenia” przedmiotów z otoczenia, „uczucie przebywania za własnym ciałem” i obserwowania go z zewnątrz;
- napady z płata potylicznego ujawniają się w zaburzeniach wzrokowych, czyli np. widzeniu kolorowych świateł, błysków, iskier, wzorków, ubytków w polu widzenia, napadowej ślepocie, także połowiczej, czasem halucynacji wzrokowych, widzeniu pomniejszonym lub powiększonym, oddalonym lub przybliżonym.
Zespoły padaczkowe występujące w padaczkach uogólnionych to:
- zespół Westa (napady zgięciowe);
- dziecięca padaczka z napadami nieświadomości, manifestująca się kilkukrotną utratą świadomości w ciągu dnia, najczęściej wywołana hiperwentylacją, stresem, brakiem snu i alkoholem;
- zespół Lennoxa-Gastauta, przebiegający z osłabieniem napięcia mięśni, nagłymi upadkami, napadami tonicznymi (wzmożone napięcie) oraz atypowymi napadami nieświadomości;
- młodzieńcza padaczka miokloniczna (JME, Janza), zaczyna się przed 30. rokiem życia, przebiega z mioklonicznymi zrywaniami mięśni, pojawiającymi się zazwyczaj o poranku; typowe są napady nieświadomości, ale mogą również wystąpić napady toniczno-kloniczne.
W padaczkach ogniskowych występują zespoły padaczkowe takie jak:
- łagodna padaczka rolandyczna – charakterystyczne są napady toniczno-kloniczne wtórnie uogólnione podczas snu; przebieg choroby jest łagodny i obejmuje napady częściowe oraz czuciowo-ruchowe twarzy z jednostronnymi zaburzeniami czucia twarzy, poprzedzone np. napadem tonicznym lub klonicznym języka, ust, gardła i krtani;
- padaczki potyliczne.

Farmakoterapia stanów padaczkowych
W ostatnich latach opublikowano wiele rekomendacji oraz standardów dotyczących diagnostyki i leczenia chorych z padaczką. Rozpoczęcie leczenia przeciwpadaczkowego musi być poprzedzone wnikliwą diagnostyką z określeniem symptomatologii napadów (jeśli to możliwe – zespołu padaczkowego) i ustaleniem ich ewentualnej etiologii.
Obecnie dysponuje się ponad 30 lekami przeciwpadaczkowymi. Lek wybiera się na podstawie wiedzy o jego skuteczności i efektywności w różnych rodzajach napadów padaczkowych lub zespołach padaczkowych oraz o możliwych działaniach niepożądanych. Przy wyborze leku należy uwzględnić wiek i płeć pacjenta, a także to, czy nie należy do jednej z grup wymagających specjalnej opieki (dzieci, kobiety w wieku rozrodczym, osoby starsze). Trzeba wziąć pod uwagę inne choroby współistniejące z padaczką oraz inne jednocześnie stosowane przez pacjenta leki.
Leki przeciwpadaczkowe można podzielić na dwie grupy:
- klasyczne: karbamazepina, kwas walproinowy, fenytoina, benzodiazepiny (głównie klonazepam, rzadziej diazepam, klobazam), etosuksimid, fenobarbital;
- nowej generacji: okskarbazepina, gabapenytyna, lamotrigina, wigabatryna, tiagabina, topiramat, felbamat, pregabalina, lewetiracetam, zonisamid.
W Tabeli 1 przedstawiono zalecenia dotyczące skuteczności poszczególnych leków przeciwpadaczkowych w wybranych typach napadów.
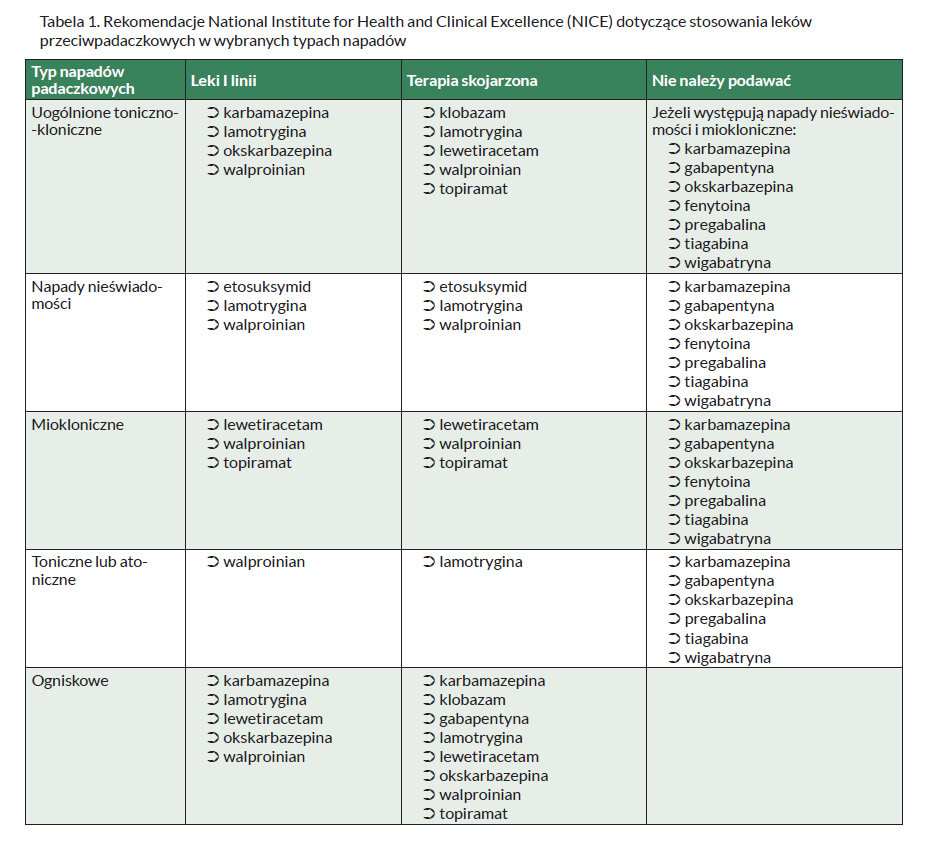
Celem leczenia jest całkowita kontrola napadów padaczkowych. Udaje się ją uzyskać u 70–80% chorych. Jest to związane z poprawnym rozpoznaniem, prawidłowym doborem leku na podstawie rodzaju napadów przy uwzględnieniu działań niepożądanych oraz z przestrzeganiem zasad stosowania leków. W przypadku niepowodzenia monoterapii należy podjąć monoterapię innym lekiem lub zastosować kombinację leków. Zmianę leku należy prowadzić stopniowo, zwiększając dawki aż do skutecznej i powoli wycofując pierwszy lek. Brak skuteczności monoterapii dwoma kolejnymi podstawowymi lekami upoważnia do wprowadzenia politerapii – dwóch leków lub rzadko trzech (ze względu na zwiększone ryzyko działań ubocznych i interakcji). Nie ma bezwzględnych wskazań do rutynowego oznaczania stężenia leków we krwi. Uzasadnione jest oznaczanie stężenia tylko leków klasycznych, co może pomóc w kontrolowaniu ich prawidłowego dawkowania. Zakończenie leczenia powinno rozważać się po co najmniej 2- lub 3-letnim okresie bez napadów, a przy nawrocie – po 5 latach od ostatniego napadu, przy prawidłowym zapisie EEG i akceptacji pacjenta. Odstawienie leków powinno trwać kilka miesięcy, a w terapii złożonej wycofuje się leki po kolei. Nie odstawia się leków w młodzieńczej padaczce mioklonicznej z napadami toniczno-klonicznymi ze względu na wysokie ryzyko nawrotów (90–100%).
Do najnowszych leków stosowanych w leczeniu padaczki zaliczamy: lakozamid, wprowadzony na terenie Unii Europejskiej w 2008 roku, który nasila wybiórczo powolną inaktywację napięciowo-zależnych kanałów sodowych, retygabinę wprowadzoną w 2011 roku oraz cenobamat zarejestrowany w 2021 roku.
Lakozamid to lek przeciwpadaczkowy zaliczany do grupy aminokwasów funkcjonalizowanych. Jego mechanizm działania nie został wyjaśniony. W warunkach in vitro lakozamid wybiórczo nasila powolną inaktywację zależnych od napięcia kanałów sodowych, co prowadzi do stabilizacji błon komórkowych nadmiernie pobudliwych neuronów. Ponadto wiąże się z białkiem-2 pośredniczącym w odpowiedzi na kolapsynę (CRMP-2) – fosfoproteiną ulegającą ekspresji głównie w układzie nerwowym, biorącą udział w różnicowaniu neuronalnym i wzroście aksonów.
Lakozamid jest wskazany w monoterapii lub leczeniu wspomagającym napadów padaczkowych częściowych i częściowo wtórnie uogólnionych u dorosłych, młodzieży i dzieci po 4. roku życia. Preparat w postaci roztworu do infuzji stanowi alternatywę dla chorych, u których podanie p.o. jest czasowo niemożliwe.
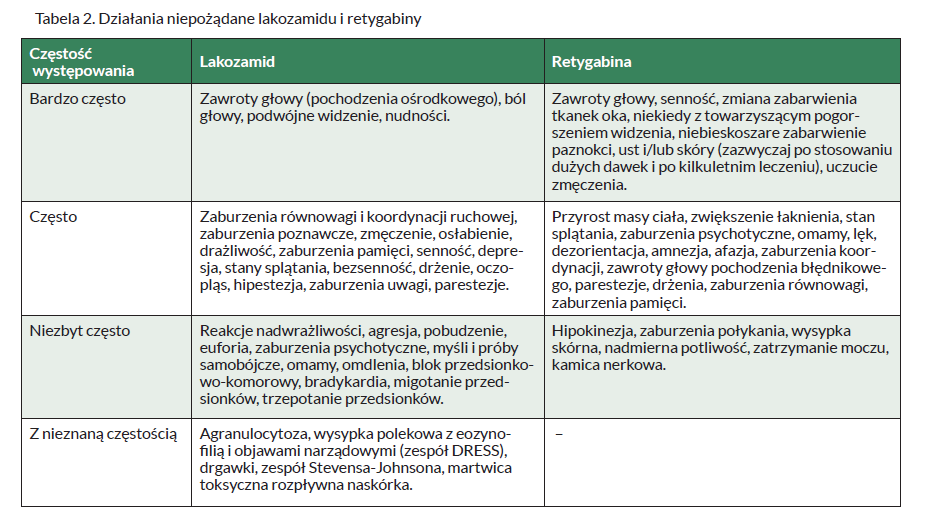
Niestety, stosowanie lakozamidu wiąże się z możliwością wystąpienia licznych działań niepożądanych. Przedstawiono je w Tabeli 2.
Karta Charakterystyki Produktu Leczniczego podaje, że lakozamid należy stosować ostrożnie u pacjentów leczonych lekami wydłużającymi odstęp PR (np. karbamazepiną, lamotryginą, pregabaliną) oraz u pacjentów leczonych lekami przeciwarytmicznymi klasy I. W badaniach in vitro lakozamid nie indukował aktywności enzymów CYP1A2, CYP2B6 i CYP2C9 ani nie hamował CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6 oraz CYP2E1. Lek nie zmienia AUC midazolamu i nie wpływa na farmakokinetykę omeprazolu (inhibitor CYP2C19). Omeprazol nie zwiększa w stopniu istotnym klinicznie ekspozycji na lakozamid. Jest mało prawdopodobne, by umiarkowane inhibitory CYP2C19 wpływały w sposób istotny klinicznie na ekspozycję układową na lakozamid. Zaleca się zachowanie ostrożności podczas równoległego stosowania silnych inhibitorów CYP2C9 (np. flukonazol) i CYP3A4 (np. itrakonazol, ketokonazol, rytonawir, klarytromycyna), które mogą zwiększać ekspozycję na lakozamid. Silne induktory enzymatyczne, takie jak ryfampicyna i preparaty dziurawca, mogą zmniejszać ekspozycję na lakozamid. Karbamazepina, fenytoina i fenobarbital, będące induktorami enzymów, zmniejszają ekspozycję na lakozamid o 25%.
Zalecane jest stosowanie leku 2 razy na dobę, od dawki początkowej 2 razy 50 mg. Dawkę można zwiększyć po tygodniu do wstępnej dawki terapeutycznej 100 mg 2 razy na dobę. Maksymalna zalecana dawka dobowa to 200 mg 2 razy na dobę. Lek po podaniu doustnym wchłania się szybko i całkowicie; 95% podanej dawki leku wydalane jest z moczem w formie niezmienionej oraz jako metabolity. Okres półtrwania leku wynosi 13 godzin, a jego farmakokinetyka jest proporcjonalna do dawki i niezmienna w czasie. Lek należy do kategorii C. Nie należy stosować lakozamidu u kobiet w ciąży, jeżeli nie jest to bezwzględnie konieczne.
Retygabina działa głównie przez otwieranie bramkowanych napięciem kanałów potasowych obecnych w neuronach (kanały Kv7,2 i Kv7,3 kodowane przez geny odpowiednio KCNQ2 i KCNQ3). Otwarcie kanałów potasowych powoduje stabilizację potencjału spoczynkowego błony i kontroluje podprogową pobudliwość elektryczną w neuronach, zapobiegając inicjacji serii potencjałów czynnościowych występujących w napadzie padaczkowym. Wskazania do stosowania retygabiny obejmują leczenie wspomagające lekoopornych napadów padaczkowych o początku ogniskowym z wtórnym uogólnieniem lub bez niego u osób dorosłych, gdy inne właściwe leczenie skojarzone okazało się niewystarczające lub nie było tolerowane.
Retygabina nie wywiera klinicznie istotnego wpływu na stężenie w osoczu leków przeciwpadaczkowych, takich jak karbamazepina, klobazam, klonazepam, gabapentyna, lamotrygina, lewetyracetam, okskarbazepina, fenobarbital, fenytoina, pregabalina, topiramat, walproinian czy zonisamid. Ponadto nie obserwowano klinicznie istotnego wpływu lamotryginy, lewetyracetamu, okskarbazepiny, topiramatu i walproinianu na farmakokinetykę retygabiny. Nie wykazano również klinicznie istotnego wpływu induktorów enzymatycznych (fenytoiny, karbamazepiny, fenobarbitalu) na klirens retygabiny. Wykazano jednak, że fenytoina i karbamazepina mogą zmniejszać ogólnoustrojową ekspozycję na retygabinę odpowiednio o 35% i 33%. Działania niepożądane retygabiny zamieszczono w Tabeli 2.
Lek jest stosowany 3 razy dziennie od dawki dobowej 300 mg, którą można zwiększać o 150 mg na dobę co tydzień, aż do osiągnięcia dawki leczniczej, w zależności od reakcji i tolerancji leku. Maksymalna dawka to 400 mg 3 razy na dobę. Nie ma wystarczających danych na temat stosowania retygabiny u kobiet w ciąży. Nie zaleca się stosowania leku u kobiet w ciąży oraz u kobiet w wieku rozrodczym niestosujących skutecznych metod antykoncepcji.
Cenobamat jest pozytywnym modulatorem allosterycznym podtypów receptora jonotropowego kwasu γ-aminomasłowego (GABAA), który nie wiąże się do miejsca wiązania pochodnych benzodiazepiny. Cenobamat powoduje również zahamowanie powtarzalnych wyładowań neuronów poprzez nasilenie inaktywacji kanałów sodowych i hamowanie składowej stałej prądu kationów sodowych.
Wskazania do stosowania cenobamatu obejmują leczenie wspomagające napadów ogniskowych ulegających albo nieulegających wtórnemu uogólnieniu u pacjentów dorosłych z padaczką, u których nie osiągnięto dostatecznej kontroli choroby pomimo zastosowania co najmniej dwóch leków przeciwpadaczkowych w przeszłości. Przeciwwskazaniem do stosowania cenobamatu jest występowanie myśli i zachowań samobójczych. Cenobamat jest metabolizowany w znacznym stopniu, głównie na drodze glukuronidacji, a w mniejszym stopniu także utleniania. Cenobamat może powodować zmniejszenie ekspozycji na leki metabolizowane głównie z udziałem izoenzymów CYP3A4 i 2B6 oraz zwiększenie ekspozycji na leki metabolizowane głównie z udziałem izoenzymu CYP2C19.
Podsumowanie
Wybór leku przeciwpadaczkowego dla określonej postaci napadów padaczkowych nie jest łatwy. Nie ma bowiem dobrych badań porównawczych w stosowaniu określonych leków w różnych postaciach klinicznych napadów. Tak więc często porównanie toksyczności jest głównym czynnikiem wpływającym na wybór leku pierwszego rzutu. Pomimo istnienia dużej liczby dostępnych leków przeciwpadaczkowych ciągle trwają poszukiwania nowych leków o dobrej skuteczności i jak najmniejszej liczbie działań niepożądanych. Jednym z kierunków poszukiwania bardziej skutecznych leków przeciwpadaczkowych są badania nad lekami pochodzenia naturalnego, czyli nad wykorzystaniem w terapii efektów biologicznych składników roślin. Takim badaniem jest ocena skuteczności wyciągu z konopi o wysokiej zawartości kanabidiolu.
Źródła:
https://neurologia-praktyczna.pl/a3756/Aktualnosci-w-leczeniu-padaczki.html/, stan z dnia 25.12.2023.
Rejdak K., Rola R., Mazurkiewicz-Bełdzińska M., Halczuk I., Błaszczyk B., Rysz A., Ryglewicz D. Diagnostyka i leczenie padaczki u osób dorosłych – rekomendacje Polskiego Towarzystwa Neurologicznego. Polski Przegląd Neurologiczny, 2016; 12 (1): 15–27.
https://indeks.mp.pl/leki/desc.php?id=7871, stan z dnia 25.12.2023.
https://indeks.mp.pl/leki/desc.php?id=12383, stan z dnia 25.12.2023.