Wróć
Wróć

Rola farmaceuty w leczeniu i monitorowaniu pacjentów z chorobami rzadkimi
- Leki „sieroce”
W grudniu 1999 r. Parlament Europejski i Rada UE przyjęły rozporządzenie regulujące kryteria oznaczania produktu leczniczego jako sierocego produktu leczniczego. Zaproponowano także ustanowienie zachęt w celu wspierania badań, rozwoju i wprowadzania do obrotu produktów leczniczych przeznaczonych do zapobiegania, diagnozowania lub leczenia rzadkich chorób[6].
Ze względu na charakterystykę farmakologiczną są to zazwyczaj produkty lecznicze do użytku szpitalnego. Są one z reguły zastrzeżone do leczenia, które może być stosowane lub kontynuowane wyłącznie w środowisku szpitalnym lub w upoważnionych ośrodkach opieki.
Większość leków sierocych w Polsce jest dostępna dla pacjentów w ramach tzw. programów lekowych. Realizują je wybrane placówki lecznicze, dostarczając chorym lek (przeważnie bardzo drogi) bezpłatnie. Kryteria włączenia do programu lekowego są jednak restrykcyjne, a więc dostępność leków dla pacjentów jest ograniczona. W krajach takich jak Stany Zjednoczone, Francja czy Belgia coraz częściej mówi się jednak o roli, którą mogłyby odgrywać apteki ogólnodostępne w poszerzeniu dostępności do farmakoterapii oraz medycznych działaniach edukacyjnych zwiększających świadomość społeczną w tym temacie[7,8,9].
- Leki sporządzane przez farmaceutę
Z powodu ograniczonej dostępności do terapii podstawowych pacjenci, którzy cierpią na choroby rzadkie, najczęściej korzystają z terapii wspomagających tzw. best supportive care. Leki te często stosowane są również w innych schorzeniach, w tym w tych powszechnych. Sporządzanie takich produktów leczniczych polega na przygotowywaniu nielicencjonowanych leków o ugruntowanej pozycji terapeutycznej, w celu zaspokojenia specyficznych potrzeb pacjentów, dla których nie istnieje na rynku lek zarejestrowany (komercyjny). Nie jest to alternatywą dla sierocych produktów leczniczych, które podlegają zwykłej ścieżce rozwoju i dopuszczenia do obrotu, lecz raczej uzupełnieniem, jeśli firmy nie są zainteresowane wprowadzeniem takiego produktu na rynek.
Unijne prawodawstwo farmaceutyczne, dyrektywa 2004/27/WE (zmieniająca dyrektywę 2001/83/WE w sprawie wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi), zezwala państwom członkowskim na dostarczanie takich leków, a mianowicie preparatów magistralnych i galenowych, zgodnie z obowiązującymi przepisami i w celu zaspokojenia szczególnych potrzeb[10]. Ważne jest, aby istniały dowody w literaturze medycznej i/lub farmaceutycznej przemawiające za takimi lekami, a także były one oparte na zasadach farmakopealnych oraz praktycznym know-how. Proces ten wspierany jest przez różne organizacje np. International Society of Pharmaceutical Compounding (ISPhC). Co ciekawe, na łamach czasopisma Frontiers in Pharmacology sporządzono listę znanych składników o ugruntowanej pozycji w lecznictwie (w tym spożywczych), które uzyskały pozwolenie na dopuszczenie do obrotu jako leki sieroce. Pomimo ochrony wynikającej z prawa własności intelektualnej, składniki te powinny być jednak traktowane jako „farmaceutyczne dobro wspólne” będące częścią ustalonej praktyki sporządzania leków recepturowych lub preparatów jałowych w aptece szpitalnej – formy produkcji w punkcie opieki farmaceutycznej[11].
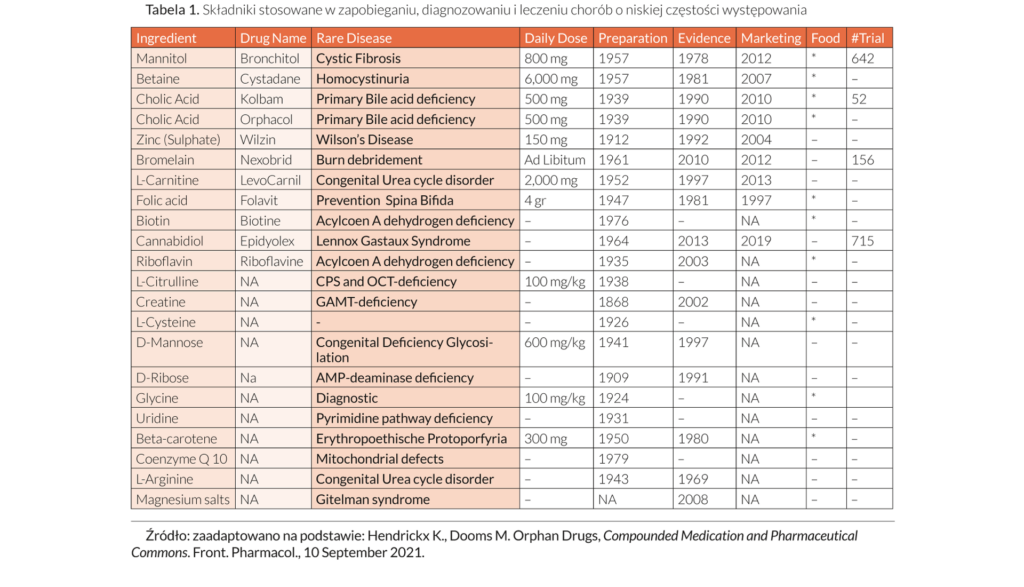
Tabela 1. wyjaśnienie: Tabela przedstawia wykaz składników, które tradycyjnie nie są uznawane za leki, ale są stosowane jako dodatki suplementy (takie jak aminokwasy i witaminy) lub hormony i które stały się komercyjnymi produktami dzięki procedurze rejestracji w EMA. Kilka z tych składników jest obecnie dopuszczonych do obrotu jako dodatki do żywności („Food” w tabeli 1). Składniki bez nazwy leku („NA” w tabeli 1) są sporządzane przez farmaceutów i nie są (jeszcze) wprowadzone do obrotu w UE. Leki o zmienionym przeznaczeniu lub leki repozycjonowane są również stosowane w leczeniu chorób rzadkich, jednak nie zostały zawarte w tabeli (repozycjonowanie leków polega na odkryciu nowego zastosowania dla już zatwierdzonych lub badanych produktów leczniczych).
Nowa rola farmaceuty w opiece nad pacjentami z chorobami rzadkimi
Choroby rzadkie, mimo że pojedynczo występują sporadycznie, są zbiorowo powszechne. Lekarze, przede wszystkim pierwszego kontaktu, mają ograniczoną wiedzę na ich temat. Powoduje to istotne opóźnienia w zdiagnozowaniu chorego (nie wspominając o wydolności polskiej służby zdrowia). Dodatkowo, nawet gdy pacjent zostanie zdiagnozowany, nie oznacza to, że otrzyma odpowiednią metodę leczenia, gdyż w większości choroby rzadkie są nieuleczalne. Dla wielu pacjentów dostęp do terapii podstawowych jest ograniczony. Ponadto brak jest adekwatnych terapii alternatywnych.
Wydaje się więc, że rola farmaceutów w zakresie leczenia i zwiększania świadomości na temat chorób rzadkich w Polsce mogłaby okazać się bardzo użyteczna, zwłaszcza w świetle wdrażania w kolejnych latach Narodowego Planu dla Chorób Rzadkich. Jaki potencjał w tym zakresie mają farmaceuci?
- W przypadku braku leczenia on-label lub nawet off-label dla pacjentów z rzadkimi chorobami, udział farmaceutów w sporządzaniu leków magistralnych bądź preparatów jałowych w aptece szpitalnej (w ramach wspomnianych wcześniej best supportive care i pharmaceutical compounding) jest kluczowy. Leki te muszą być wykonywane w najlepszych możliwych warunkach przez przeszkolonych specjalistów, którzy postępują zgodnie z zatwierdzonymi procedurami.
- Farmaceuci są nierzadko pierwszym punktem kontaktu, do którego pacjent lub rodzic pacjenta (w przypadku chorób rzadkich pacjentami są bardzo często dzieci) zwraca się o pomoc. Rozsądne wydaje się więc, by posiadali oni poszerzoną wiedzę z tej dziedziny oraz z zakresu potrzeb pacjenta, którą mogliby wykorzystywać w ramach świadczonej w aptekach opieki farmaceutycznej.
Istnieje ok. 8000 różnych chorób rzadkich, które zostały sklasyfikowane w 24 głównych grupach fenotypowych i są reprezentowane przez taką samą liczbę odpowiadających im europejskich sieci referencyjnych. Orphanet zawiera informacje o 6172 unikalnych chorobach rzadkich, 72% z nich ma podłoże genetyczne, a prawie 70% rozpoczyna się z reguły w wieku dziecięcym.
- Farmaceuci mogliby być również zaangażowani we wspieranie inicjatyw mających na celu lokalne działania informacyjne.
- Mogliby stanowić wykwalifikowany personel w modelu (nieistniejącej jeszcze) kompleksowej opieki nad pacjentem z chorobą rzadką.
- Rejestracja pacjentów w wybranych aptekach ogólnodostępnych zapewniłaby znaczące korzyści dla osób z chorobami rzadkimi, oferując bardziej spójne doświadczenie pacjenta dzięki powtarzalnym interakcjom z tym samym farmaceutą, który mógłby doradzać i monitorować pacjentów w celu lepszego przestrzegania zaleceń.
Uzasadnione wydaje się więc, że środowiska zrzeszające magistrów farmacji w Polsce powinny dążyć do aktywnego włączenia się w planowane działania związane z realizacją założeń rządowego planu odnośnie chorób rzadkich.
Źródła
[1] European Medicines Agency (EMA) Orphan Designation (2021): Overview. Link: https://www.ema.europa.eu/en/human-regulatory/overview/orphan-designation-overview
[2] Nguengang Wakap S, Lambert DM, Olry A, et al. Estimating cumulative point prevalence of rare diseases: analysis of the Orphanet database. Eur J Hum Genet. 2020 Feb;28(2):165-173
[3] The International Federation of Pharmaceutical Manufacturers & Associations. Link: https://www.ifpma.org/subtopics/rare-diseases/
[4] Prawo.pl. Link: https://www.prawo.pl/zdrowie/plan-dla-chorob-rzadkich-uchwala-rzadu,506787.html
[5] European Commission (2021). Public Health - Union Register of Medicinal Products. Link: https://ec.europa.eu/health/documents/community-register/html/index_en.htm
[6] Rozporządzenie (WE) nr 141/2000 Parlamentu Europejskiego i Rady z dnia 16 grudnia 1999 r. w sprawie sierocych produktów leczniczych.
[7] Vanhoorne V., Peeters1 E., Van Tongelen I., et al. Pharmaceutical compounding of orphan active ingredients in Belgium: how community and hospital pharmacists can address the needs of patients with rare diseases. Orphanet Journal of Rare Diseases (2019) 14:186
[8] Managed Healthcare Executive (2019). Link: https://www.managedhealthcareexecutive.com/view/specialty-pharmacys-role-improving-orphan-drug-channels
[9] Bourdoncle, M., Juillard-Condat, B., Taboulet, F. Patient access to orphan drugs in France. Orphanet J Rare Dis (2019) 14, 47
[10] Dooms M., Carvalho M. Compounded medication for patients with rare diseases. Orphanet J Rare Dis (2018) 13, 1
[11] Hendrickx K, Dooms M. Orphan Drugs, Compounded Medication and Pharmaceutical Commons. Front. Pharmacol., 10 September 2021.